题目内容
9.现有一定量含有Na2O杂质的Na2O2试样,用图的实验装置测定Na2O2试样的纯度,实验时将样品放置于D中.(可供选用的反应物只有CaCO3固体、6mol/L盐酸、6mol/L硫酸和蒸馏水)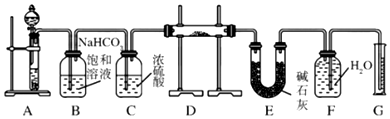
回答下列问题:
(1)装置A中液体试剂选用6mol/L盐酸.
(2)装置B的作用是除去气体中的HCl.装置C的作用是干燥气体.装置E中碱石灰的作用是吸收装置D中反应剩余的二氧化碳.
(3)装置D中发生反应的化学方程式是2Na2O2+2CO2=2Na2CO3+O2、Na2O+CO2=Na2CO3.
(4)若开始时测得样品的质量为2.0g,反应结束后测得气体体积为224mL(标准状况),则Na2O2试样的纯度为78%.
分析 (1)根据实验原理装置A采用的是碳酸钙和盐酸反应生成二氧化碳,根据碳酸钙和硫酸反应的情况来回答;
(2)获得的二氧化碳气体中含有氯化氢气体,可以用饱和碳酸氢钠来除去,浓硫酸具有吸水性,碱石灰可以吸收二氧化碳;
(3)根据氧化钠和过氧化钠的性质来回答;
(4)根据氧气的量和过氧化钠量的关系来获得过氧化钠质量,进而计算过氧化钠的纯度.
解答 解:(1)装置A是碳酸钙和盐酸反应生成二氧化碳,碳酸钙和硫酸反应时,生成的硫酸钙是微溶于水的,会覆盖在碳酸钙的表面,使反应不能持续,所以用盐酸而不用硫酸来反应,
故答案为:6mol/L盐酸;
(2)碳酸钙和盐酸反应生成的二氧化碳气体中含有氯化氢气体,可以用饱和碳酸氢钠来除去,浓硫酸具有吸水性,可以将二氧化碳干燥,装置E中碱石灰的作用是吸收二氧化碳,防止对氧气的体积测量造成干扰,
故答案为:除去气体中的HCl;干燥气体;吸收装置D中反应剩余的二氧化碳;
(3)氧化钠和过氧化钠和二氧化碳反应的原理方程式分别为:2Na2O2+2CO2=2Na2CO3+O2,Na2O+CO2=Na2CO3,
故答案为:2Na2O2+2CO2=2Na2CO3+O2;Na2O+CO2=Na2CO3;
(4)根据反应2Na2O2+2CO2=2Na2CO3+O2,反应结束后测得气体体积为224mL(标准状况),即生成的氧气的量0.01mol,过氧化钠的物质的量为0.02mol,
过氧化钠的纯度=$\frac{0.02mol×78g/mol}{2.0g}$×100%=78%,
故答案为:78%.
点评 本题考查学生过氧化钠的化学性质知识,通过实验方式考查增加了难度,综合性较强,题目难度中等.

练习册系列答案
相关题目
14.下列叙述正确的是( )
| A. | 甲酸溶液导电性比乙酸溶液导电性强,说明乙酸是弱酸 | |
| B. | 硫酸钾溶于水能导电,所以硫酸钾是电解质 | |
| C. | 强电解质一定是含有离子键,弱电解质中一定含弱极性共价键 | |
| D. | 固态磷酸是电解质,所以磷酸在熔融状态下和水溶液中都能导电 |
15.根据下列实验或实验操作和现象,所得结论正确的是( )
| 实验或实验操作 | 现象 | 实验结论 | |
| A | 用大理石和盐酸反应制取CO2 气体,立即通入一定浓度的Na2SiO3 溶液中 | 出现白色沉淀 | 非金属性:Cl>C>Si |
| B | 向某溶液先滴加硝酸酸化,再滴加BaCl2溶液 | 有白色沉淀生成 | 原溶液中含有SO42-、SO32-、HSO3-中的一种或几种 |
| C | 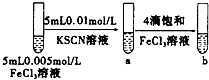 | 试管b比试管a中溶液的红色深 | 增大反应物浓度,平衡向正反应方向移动 |
| D |  | 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
| A. | A | B. | B | C. | C | D. | D |
17.将质量为m1g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体11.2L.向溶液中逐滴加入浓度为4mol•L-1的HCl溶液,至100mL时白色沉淀达到最大量.继续滴入HCl溶液,当加入HCl溶液体积VmL时沉淀恰好消失.将所得溶液蒸干灼烧得固体m2g.下列关系式中不正确的是( )
| A. | V=150 mL | B. | m1=14.6g | ||
| C. | 白色沉淀最大量为15.6g | D. | m2=10.2g |
4.写出下列反应的热化学方程式:
(1)3mol NO2(g)与1mol H2O(l)反应生成HNO3(aq)和NO(g),放热138kJ.3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)△H=-138kJ/mol;
(2)用CO还原1mol Fe2O3,放热24.8kJ.3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)△H=-24.8kJ/mol;
(3)1mol HgO(s)分解为液态汞和氧气,吸热90.7kJ.HgO(s)=Hg(l)+$\frac{1}{2}$O2(g)△H=+90.7kJ/mol;
(4)卫星发射时可用肼(N2H4)作燃料,1mol N2H4(l)在O2(g)中燃烧,生成N2(g)和H2O(l),放出622kJ热量:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-622kJ/mol;
(5)6.4g液态甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式2CH3OH(1)+3O2(g)═2CO2(g)+4H2O(l)△H=-1135kJ/mol;
(6)已知反应N2+3H2?2NH3△H=a kJ•mol-1.试根据下表中所列键能数据估算a的数值为-93;
(7)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ•mol-1
2C2H2(g )+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变△H=+226.7kJ•mol-1.
(1)3mol NO2(g)与1mol H2O(l)反应生成HNO3(aq)和NO(g),放热138kJ.3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)△H=-138kJ/mol;
(2)用CO还原1mol Fe2O3,放热24.8kJ.3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)△H=-24.8kJ/mol;
(3)1mol HgO(s)分解为液态汞和氧气,吸热90.7kJ.HgO(s)=Hg(l)+$\frac{1}{2}$O2(g)△H=+90.7kJ/mol;
(4)卫星发射时可用肼(N2H4)作燃料,1mol N2H4(l)在O2(g)中燃烧,生成N2(g)和H2O(l),放出622kJ热量:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-622kJ/mol;
(5)6.4g液态甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式2CH3OH(1)+3O2(g)═2CO2(g)+4H2O(l)△H=-1135kJ/mol;
(6)已知反应N2+3H2?2NH3△H=a kJ•mol-1.试根据下表中所列键能数据估算a的数值为-93;
| 化学键 | H-H | N-H | N≡N |
| 键能kJ/mol | 436 | 391 | 945 |
已知:C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ•mol-1
2C2H2(g )+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变△H=+226.7kJ•mol-1.
1.某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol•L-1.
甲同学欲探究废水的组成,进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察).
②取少量溶液,加入KSCN溶液无明显变化.
③另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变.
④向③中所得的溶液中加入BaCl2溶液,有白色沉淀生成.
请推断:
(1)由①、②、③判断,溶液中一定不含有的阳离子是K+、Fe3+,一定不含的阴离子是CO32-、SiO32-(写离子符号).
(2)③中加入少量盐酸生成无色气体的离子方程式是3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,④中生成白色沉淀的离子方程式是SO42-+Ba2+=BaSO4↓.
(3)将③中所得红棕色气体通入水中,气体变无色,所发生的化学反应方程式为3NO2+H2O=2HNO3+NO.
(4)甲同学最终确定原溶液中所含阳离子是Fe2+、Mg2+,阴离子是Cl-、NO3-、SO42-.(写离子符号)
| 阳离子 | K+ Mg2+ Fe3+ Al3+ Fe2+ |
| 阴离子 | Cl-CO32- NO3- SO42- SiO32- |
①用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察).
②取少量溶液,加入KSCN溶液无明显变化.
③另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变.
④向③中所得的溶液中加入BaCl2溶液,有白色沉淀生成.
请推断:
(1)由①、②、③判断,溶液中一定不含有的阳离子是K+、Fe3+,一定不含的阴离子是CO32-、SiO32-(写离子符号).
(2)③中加入少量盐酸生成无色气体的离子方程式是3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,④中生成白色沉淀的离子方程式是SO42-+Ba2+=BaSO4↓.
(3)将③中所得红棕色气体通入水中,气体变无色,所发生的化学反应方程式为3NO2+H2O=2HNO3+NO.
(4)甲同学最终确定原溶液中所含阳离子是Fe2+、Mg2+,阴离子是Cl-、NO3-、SO42-.(写离子符号)
18.在一个绝热的容积固定的密闭容器中发生可逆反应:mA(g)+nB(g)?pC(g)+qD(g),当 m、n、p、q 为任意整数时,反应达到平衡的标志是:①体系的密度不再改变,②体系的温度不再改变,③A 的转化率不再改变,④各组分的百分含量不再改变,⑤反应 速率,v(A):v(B):v(C):v(D)=m:n:p:q.下列组合完全正确的是( )
| A. | ②③④ | B. | ①③⑤ | C. | ②④⑤ | D. | ①②③④⑤ |
19.下列说法中正确的是( )
| A. | 在多电子的原子里,能量高的电子通常在离核较近的区域内运动 | |
| B. | 凡单原子形成的稳定离子,一定具有稀有气体元素原子的8电子稳定结构 | |
| C. | Na2O2属于离子化合物,熔化时只破坏离子键,不破坏O-O共价键 | |
| D. | 俄国化学家道尔顿为元素周期表的建立作出了巨大贡献 |
