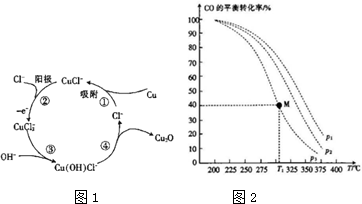
题目内容
15.根据下列实验或实验操作和现象,所得结论正确的是( )| 实验或实验操作 | 现象 | 实验结论 | |
| A | 用大理石和盐酸反应制取CO2 气体,立即通入一定浓度的Na2SiO3 溶液中 | 出现白色沉淀 | 非金属性:Cl>C>Si |
| B | 向某溶液先滴加硝酸酸化,再滴加BaCl2溶液 | 有白色沉淀生成 | 原溶液中含有SO42-、SO32-、HSO3-中的一种或几种 |
| C | 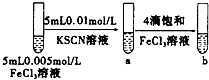 | 试管b比试管a中溶液的红色深 | 增大反应物浓度,平衡向正反应方向移动 |
| D |  | 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.比较非金属性,应用最高价氧化物的水化物的酸性强弱比较;
B.可能生成AgCl沉淀;
C.滴加饱和氯化铁,铁离子浓度增大,试管b比试管a中溶液的红色深,可说明平衡移动;
D.氯气和溴都可氧化KI.
解答 解:A.比较非金属性,应用最高价氧化物的水化物,应盐酸只能比较酸性强弱,不能比较非金属性,故A错误;
B.向某溶液先滴加硝酸酸化,再滴加BaCl2溶液,可能生成AgCl沉淀不能排出银离子的干扰,故B错误;
C.滴加饱和氯化铁,铁离子浓度增大,试管b比试管a中溶液的红色深,可说明平衡向正反应方向移动,故C正确;
D.氯气和溴都可氧化KI,生成的溴中混有氯气,不能比较溴、碘的氧化性,故D错误.
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及离子检验、平衡移动、性质比较等知识点,明确实验原理、物质性质差异性是解本题关键,侧重考查学生实验操作、实验分析及评价能力,注意把握实验的严密性和可行性的评价.

练习册系列答案
相关题目
5.已知W、X、Y、Z为原子序数依次增大的短周期元素,W、Z同主族,X、Y、Z同周期,下列说法正确的是( )
| A. | W、X、Y、Z不可能全为非金属元素 | |
| B. | W的简单气态氢化物的沸点一定高于Z的简单气态氢化物的沸点 | |
| C. | 若W、X、Y的原子序数依次相差2,则在工业上制备Y的单质时,W、X、Y形成的化合物起到了重要作用 | |
| D. | 若W与X的原子序数相差4,则Z与X形成的化合物一定是离子化合物 |
6.下列反应离子方程式正确的是( )
| A. | 向NaOH溶液中通入氯气:2OH-+Cl2═Cl-+ClO-+H2O | |
| B. | 氨气与盐酸反应:NH3+HCl═NH4++Cl- | |
| C. | 碳酸钙跟醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 将稀硝酸滴在铁片上:Fe+2H+═Fe2++H2↑ |
3.X、Y、Z、M为原子序数依次增大的四种短周期元素.X、Y、Z同周期且相邻,M为唯一一种金属元素且最外层电子数为X、Y、Z最外层电子数之和的$\frac{1}{5}$.下列说法不正确的是( )
| A. | X、Y、Z形成的气态氢化物中稳定性最强的是H2Z | |
| B. | Y所在族的氢化物的沸点最高的是Y对应的氢化物 | |
| C. | 离子半径的大小:M>Y>Z | |
| D. | M的最高价氧化物对应的水化物可以溶解于Y对应最高价含氧酸 |
10.下列物质间的转化需要加入氧化剂才能进行的是( )
| A. | NaOH→NaCl | B. | C→CO2 | C. | Fe2O3→Fe | D. | NaHCO3→Na2CO3 |
12.常温常压下,a体积的下列几种气态烃的混合物与足量氧气混合点燃爆炸,恢复到原来状态时,体积共缩小了2a体积,则该混合烃的组合可能是( )
①CH4 ②C2H4 ③C2H6 ④C3H4 ⑤C3H6 ⑥C3H8.
①CH4 ②C2H4 ③C2H6 ④C3H4 ⑤C3H6 ⑥C3H8.
| A. | ③⑤ | B. | ①②④ | C. | ②③ | D. | ④⑤⑥ |
10.下列有关物质的性质与应用对应的是( )
| A. | NH4Cl受热易分解,可用于实验室制氨气 | |
| B. | 液氨汽化时能吸收大量的热,使周围温度急剧降低,因此可用作制冷剂 | |
| C. | NO2气体有毒,且可以和水反应,实验室多余的NO2气体用水吸收即可 | |
| D. | N2性质稳定,工业生产金属镁时,为防止其氧化,可以用N2作保护气 |