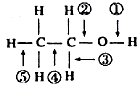
题目内容
18.在一个绝热的容积固定的密闭容器中发生可逆反应:mA(g)+nB(g)?pC(g)+qD(g),当 m、n、p、q 为任意整数时,反应达到平衡的标志是:①体系的密度不再改变,②体系的温度不再改变,③A 的转化率不再改变,④各组分的百分含量不再改变,⑤反应 速率,v(A):v(B):v(C):v(D)=m:n:p:q.下列组合完全正确的是( )| A. | ②③④ | B. | ①③⑤ | C. | ②④⑤ | D. | ①②③④⑤ |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:①体系的密度一直不变,故错误;
②体系的温度不再改变,说明正逆反应速率相等,达平衡状态,故正确;
③A 的转化率不再改变,说明消耗与生成速率相等,达平衡状态,故正确;
④各组分的百分含量不再改变,说明正逆反应速率相等,达平衡状态,故正确;
⑤只要反应发生就有反应速率,v(A):v(B):v(C):v(D)=m:n:p:q,故错误;
故选A.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
相关题目
3.X、Y、Z、M为原子序数依次增大的四种短周期元素.X、Y、Z同周期且相邻,M为唯一一种金属元素且最外层电子数为X、Y、Z最外层电子数之和的$\frac{1}{5}$.下列说法不正确的是( )
| A. | X、Y、Z形成的气态氢化物中稳定性最强的是H2Z | |
| B. | Y所在族的氢化物的沸点最高的是Y对应的氢化物 | |
| C. | 离子半径的大小:M>Y>Z | |
| D. | M的最高价氧化物对应的水化物可以溶解于Y对应最高价含氧酸 |
6.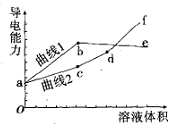 分别用浓度均为0.5mol/L的NH3•H2O和NaOH溶液,滴定20mL0.01mol/L Al2(SO4)3溶液,随滴定溶液体积的增大,溶液的导电能力变化曲线如图所示,下列说法中正确的是( )
分别用浓度均为0.5mol/L的NH3•H2O和NaOH溶液,滴定20mL0.01mol/L Al2(SO4)3溶液,随滴定溶液体积的增大,溶液的导电能力变化曲线如图所示,下列说法中正确的是( )
 分别用浓度均为0.5mol/L的NH3•H2O和NaOH溶液,滴定20mL0.01mol/L Al2(SO4)3溶液,随滴定溶液体积的增大,溶液的导电能力变化曲线如图所示,下列说法中正确的是( )
分别用浓度均为0.5mol/L的NH3•H2O和NaOH溶液,滴定20mL0.01mol/L Al2(SO4)3溶液,随滴定溶液体积的增大,溶液的导电能力变化曲线如图所示,下列说法中正确的是( )| A. | 曲线2 代表滴加NH3•H2O溶液的变化曲线 | |
| B. | b和d点对应的溶液均显碱性 | |
| C. | b点溶液中c(NH4+ )>c(SO42- )>c(H+ )>c(OH- ) | |
| D. | df段导电能力升高的原因是发生了反应Al(OH)3+OH-═[Al(OH)4]- |
13.将14g铜银合金与足量的HNO3反应,将产生的气体与1.12L O2(标准状况下)混合后,通入水中,恰好被全部吸收,则合金中Ag的质量为( )
| A. | 3.2 g | B. | 4.8 g | C. | 6.4 g | D. | 10.8 g |
10.下列有关物质的性质与应用对应的是( )
| A. | NH4Cl受热易分解,可用于实验室制氨气 | |
| B. | 液氨汽化时能吸收大量的热,使周围温度急剧降低,因此可用作制冷剂 | |
| C. | NO2气体有毒,且可以和水反应,实验室多余的NO2气体用水吸收即可 | |
| D. | N2性质稳定,工业生产金属镁时,为防止其氧化,可以用N2作保护气 |

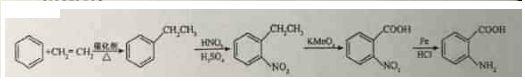
 →-N=
→-N=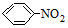 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$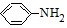 (易被氧化).请回答:
(易被氧化).请回答: ;
;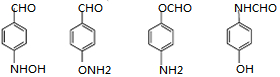 ;
; .
.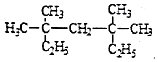 系统命名法为3,3,5,5-四甲基庚烷;
系统命名法为3,3,5,5-四甲基庚烷;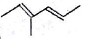 表示的有机物的结构简式是CH3CH=C(CH3)CH=CHCH3;
表示的有机物的结构简式是CH3CH=C(CH3)CH=CHCH3;