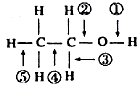
题目内容
19.下列说法中正确的是( )| A. | 在多电子的原子里,能量高的电子通常在离核较近的区域内运动 | |
| B. | 凡单原子形成的稳定离子,一定具有稀有气体元素原子的8电子稳定结构 | |
| C. | Na2O2属于离子化合物,熔化时只破坏离子键,不破坏O-O共价键 | |
| D. | 俄国化学家道尔顿为元素周期表的建立作出了巨大贡献 |
分析 A.多电子原子中,在离核较近的区域内运动的电子能量较低;
B.单原子形成的离子不一定具有稀有气体原子的核外电子排布;
C.物质由固态转化为液态时共价键不被破坏;
D.俄国化学家门捷列夫对元素周期表做出了巨大贡献.
解答 解:A.在含有多个电子的原子里能量高的电子在离核较远的区域内运动,故A错误;
B.单原子形成的离子不一定具有稀有气体原子的核外电子排布,如H+,故B错误;
C.物质由固态转化为液态时共价键不被破坏,Na2O2熔化时不破坏O-O共价键,故C正确;
D.俄国化学家门捷列夫对元素周期表做出了巨大贡献,而不是道尔顿,故D错误.
故选:C.
点评 本题考查了原子结构、原子核外电子排布、化学键及化学历史知识,题目难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
10.下列有关物质的性质与应用对应的是( )
| A. | NH4Cl受热易分解,可用于实验室制氨气 | |
| B. | 液氨汽化时能吸收大量的热,使周围温度急剧降低,因此可用作制冷剂 | |
| C. | NO2气体有毒,且可以和水反应,实验室多余的NO2气体用水吸收即可 | |
| D. | N2性质稳定,工业生产金属镁时,为防止其氧化,可以用N2作保护气 |
4.设NA为阿伏加德罗常数的值,则下列说法正确的是( )
| A. | 标准状况下,2.24 LCCl4中含Cl原子数目为0.4NA | |
| B. | 28g聚乙烯中所含原子数为6NA | |
| C. | 0.1mol苯乙烯中含有双键的数目为0.4NA | |
| D. | 常温常压下,10 g 46%酒精水溶液中含氧原子总数为0.1NA |
11.下列反应中,不属于可逆反应的是( )
| A. | 2NO2=N2O4与N2O4=2NO2 | |
| B. | H2+I2$\frac{\underline{\;\;△\;\;}}{\;}$2HI与2HI$\frac{\underline{\;\;△\;\;}}{\;}$H2+I2 | |
| C. | CO2+H2O=H2CO3与 H2CO3=CO2↑+H2O | |
| D. | CaO+CO2=CaCO3与CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ |
8.三种短周期A、B、C在元素周期表中的位置如表所示.已知A、B、C三种元素的原子最外层电子数之和为15.据此填空:
(1)写出B的元素符号:P,A元素的最高价氧化物的电子式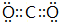 .
.
(2)C元素的某种氢化物可用于实验室中制取O2,其化学式为H2O2.
(3)A元素的某种氢化物是天然气的主要成分,其在光照条件下可以与Cl2发生取代反应,该反应的产物有5种.
(4)写出C的气态氢化物与A的单质反应的化学方程式C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2.
| A | C | |
| B |
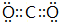 .
.(2)C元素的某种氢化物可用于实验室中制取O2,其化学式为H2O2.
(3)A元素的某种氢化物是天然气的主要成分,其在光照条件下可以与Cl2发生取代反应,该反应的产物有5种.
(4)写出C的气态氢化物与A的单质反应的化学方程式C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2.
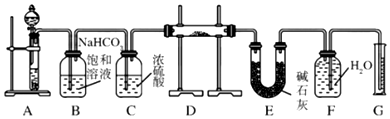
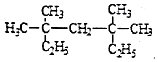 系统命名法为3,3,5,5-四甲基庚烷;
系统命名法为3,3,5,5-四甲基庚烷;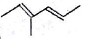 表示的有机物的结构简式是CH3CH=C(CH3)CH=CHCH3;
表示的有机物的结构简式是CH3CH=C(CH3)CH=CHCH3;