题目内容
6.草酸是一种重要的试剂.下面是利用草酸探究浓度对反应速率影响的实验.(1)为证明浓度对反应速率的影响,曾有教科书《化学反应原理》设计了如下实验:取两支试管,各加入4mL0.01mol•L-1的KMnO4酸性溶液,分别向其中加入0.1mol•L-1、0.2mol•L-1 H2C2O4溶液2mL,记录溶液褪色所需时间.
实验中发生反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
预期现象是:
①溶液的颜色由紫色变为无色,
②其中加入0.2mol•L-1H2C2O4的那支试管中的溶液先变色.
然而实验结果并不尽如人意.实验过程颜色复杂,且褪色先缓慢,后逐渐加快;最大的问题是草酸浓度大,反应速率却更慢.
本实验能否作为课堂实验研究浓度对化学反应速率的影响?适宜的条件是怎样的?某校一研究小组对此进行了探究.下面是他们的实验报告的一部分:
表1 试验安排及结果
| 实验 编号 | A(KMnO4溶液浓度/mol•L-1) | B(草酸溶液浓度/mol•L-1) | C(硫酸溶液浓度/mol•L-1) | 褪色时间/s |
| 1 | 3 | 3 | 1 | 336 |
| 2 | 1 | 2 | 3 | 82 |
| 3 | 3 | 1 | 3 | 76 |
| 4 | 1 | 3 | 2 | 133 |
| 5 | 2 | 3 | 3 | 102 |
| 6 | 3 | 2 | 2 | 156 |
| 7 | 2 | 2 | 1 | 300 |
| 8 | 2 | 1 | 2 | 115 |
| 9 | 1 | 1 | 1 | 200 |
表2 各因素水平的数据处理结果
| A(KMnO4溶液) | B(草酸溶液) | C(硫酸溶液) | |||||||
| 浓度/mol•L-1 | 0.005 | 0.010 | 0.015 | 0.1 | 0.5 | 0.9 | 6 | 12 | 18 |
| 平均褪色时间/s | 138.3 | 172.3 | 189.3 | 130.3 | 179.3 | 190.3 | 278.7 | 134.7 | 86.7 |
(3)由表2可知,当高锰酸钾浓度为0.005mol•L-1、草酸浓度为0.1mol•L-1时,反应最快.即因素A、B的较适宜实验条件得以确定.
根据以上实验结果,该小组同学继续探究硫酸的浓度是怎样影响本反应速率的,测得如下实验结果:
表3 不同硫酸浓度下的褪色时间
| c(H2SO4)/mol•L-1 | 18 | 16 | 14 | 12 | 10 | 8 | 6 |
| 褪色时间/s | 67 | 83 | 90 | 103 | 129 | 146 | 200 |
结论:草酸与酸性高锰酸钾溶液的反应,可作为课堂实验探究浓度对反应速率的影响.
分析 (1)酸性高锰酸钾溶液具有强氧化性,能氧化草酸根离子生成二氧化碳,同时自身被还原生成二价锰离子,根据氧化还原反应得失电子守恒配平反应方程式;
①酸性高锰酸钾溶液具有强氧化性,自身被还原生成无色的二价锰离子;
②增大反应物的浓度,加快反应速率;
(2)由KMnO4溶液、草酸溶液和硫酸溶液的浓度的改变对褪色时间的影响来分析;
(3)从表2可知,褪色耗时越短,反应速率越快;
(4)褪色时间约1分钟和2分钟,即60S和120S,据表解答.
解答 解:(1)酸性高锰酸钾溶液具有强氧化性,能氧化草酸根离子生成二氧化碳,同时自身被还原生成二价锰离子,离子反应方程式为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O,
故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
①酸性高锰酸钾溶液具有强氧化性,自身被还原生成无色的二价锰离子,故现象为由紫色变为无色,
故答案为:紫;无;
②增大反应物的浓度,能加快反应速率,故0.2mol•L-1H2C2O4的试管反应速率快,先变色,
故答案为:0.2;
(2)从表格的数据可以看出,硫酸浓度的改变对反应速率影响较显著,而KMnO4溶液、草酸溶液浓度的改变对反应速率的影响相对不太明显,
故答案为:C;A和B;
(3)从表2可知,褪色耗时越短,反应速率越快,故当高锰酸钾浓度为 0.005mol•L-1、草酸浓度为 0.1mol•L-1时,反应最快,
故答案为:0.005;0.1;
(4)褪色时间约1分钟和2分钟,即60S和120S,据表可知,此时硫酸的浓度分别为18mol/L和10mol/L,
故答案为:18;10.
点评 提高实验探究温度等外界条件对化学反应速率的影响规律和离子方程式的书写,难度不大.

练习册系列答案
相关题目
15.利用下列反应不能制得括号中纯净物的是 ( )
| A. | 等物质的量氯气与乙烷在光照条件下反应(氯乙烷) | |
| B. | 乙烯与水加成(乙醇) | |
| C. | 乙烯与氯气加成(1,2-二氯乙烷) | |
| D. | 乙烯与氢气加成(乙烷) |
16.下列化学用语使用科学规范的是( )
| A. | 35Cl和37Cl的原子结构示意图均为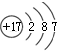 | |
| B. | HCI的形成过程为 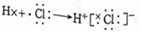 | |
| C. | 乙烯的结构简式为CH2CH2 | |
| D. | 草酸的电离过程为H2C2O4?2H++C2O42- |
13.最新研究表明,以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,下列有关说法正确的是( )
| A. | 乙酸是非电解质 | |
| B. | 上述制备乙酸的化学方程式为CO2+CH4$\stackrel{Cu_{2}Al_{2}O_{2}}{→}$CH3COOH | |
| C. | 上述制备乙酸的反应中原子利用率为80% | |
| D. | 乙酸没有同分异构体 |
1.已知乙醛(CH3CHO)和新制氢氧化铜的反应如下:CH3CHO+2Cu(OH)2+NaOH $\stackrel{△}{→}$ CH3COONa+Cu2O↓+3H2O某实验小组做上述反应时,发现NaOH的用量对反应产物有影响,于是他们采用控制变量的方法,均使用0.5mL 40%的乙醛溶液进行下列实验.
(1)上表中a、b应为B(填字母序号).
A.15滴,1mL B.2mL,1mL C.15滴,2mL D.2mL,2mL
(2)查阅资料可知,实验1中的浅蓝绿色沉淀主要成份为Cu2(OH)2SO4,受热不易分解.写出生成Cu2(OH)2SO4反应的化学方程式2NaOH+2CuSO4═Cu2(OH)2SO4↓+Na2SO4.基于实验1、2的现象可以得出结论:NaOH用量较少时,乙醛未参与氧化反应,(或是含铜元素的化合物在发生变化).
(3)小组同学推测实验3中的红褐色沉淀可能是CuO和Cu2O的混合物,其依据是依据现象提出依据:实验2中的黑色沉淀可能是CuO;实验4中的红色沉淀可能是Cu2O,所以实验3中的红褐色沉淀,可能是CuO和Cu2O的混合物.
依据理论提出依据:当NaOH用量逐渐增多时,产生的Cu(OH)2一部分受热分解生成黑色的CuO;另一部分被乙醛还原为Cu2O红色沉淀,所以实验3中的红褐色沉淀,可能是CuO和Cu2O的混合物.
(4)为了进一步证明实验4中红色沉淀的成分,该小组同学查阅资料得知:Cu2O在碱性条件下稳定,在酸性溶液中可转化为Cu2+、Cu.并进行了以下实验.
ⅰ.将实验4反应后的试管静置,用胶头滴管吸出上层清液.
ⅱ.向下层浊液中加入过量稀硫酸,充分振荡、加热,应观察到的现象是溶液变为蓝色,有红色固体.
(5)小组同学继续查阅资料得知:Cu(OH)2可与OH-继续反应生成蓝紫色溶液([Cu(OH)4]2-),由此提出问题:[Cu(OH)4]2-能否与乙醛发生反应,生成红色沉淀?设计实验解决这一问题,合理的实验步骤是将1mL2%CuSO4溶液与3mL(或>3mL)10%NaOH溶液混合振荡后(或取实验5的蓝紫色溶液),加入0.5mL40%的乙醛溶液,水浴加热.基于上述实验,该小组同学获得结论:乙醛参与反应生成红色沉淀时,需控制体系的pH>10.
| 编号 | 2%CuSO4溶液的体积 | 10%NaOH溶液的体积 | 振荡后的现象 | pH | 加乙醛水浴加热后的沉淀颜色 |
| 1 | 2mL | 3滴 | 浅蓝绿色沉淀 | 5~6 | 浅蓝绿色沉淀 |
| 2 | a | 15滴 | 浅蓝色沉淀 | 7~8 | 黑色沉淀 |
| 3 | 1mL | 1mL | 蓝色悬浊沉淀较少 | 9~10 | 红褐色沉淀 |
| 4 | b | 2mL | 蓝色悬浊沉淀较多 | 11~12 | 红色沉淀 |
| 5 | 1mL | 3mL | 蓝紫色溶液 | 12~13 | ---- |
A.15滴,1mL B.2mL,1mL C.15滴,2mL D.2mL,2mL
(2)查阅资料可知,实验1中的浅蓝绿色沉淀主要成份为Cu2(OH)2SO4,受热不易分解.写出生成Cu2(OH)2SO4反应的化学方程式2NaOH+2CuSO4═Cu2(OH)2SO4↓+Na2SO4.基于实验1、2的现象可以得出结论:NaOH用量较少时,乙醛未参与氧化反应,(或是含铜元素的化合物在发生变化).
(3)小组同学推测实验3中的红褐色沉淀可能是CuO和Cu2O的混合物,其依据是依据现象提出依据:实验2中的黑色沉淀可能是CuO;实验4中的红色沉淀可能是Cu2O,所以实验3中的红褐色沉淀,可能是CuO和Cu2O的混合物.
依据理论提出依据:当NaOH用量逐渐增多时,产生的Cu(OH)2一部分受热分解生成黑色的CuO;另一部分被乙醛还原为Cu2O红色沉淀,所以实验3中的红褐色沉淀,可能是CuO和Cu2O的混合物.
(4)为了进一步证明实验4中红色沉淀的成分,该小组同学查阅资料得知:Cu2O在碱性条件下稳定,在酸性溶液中可转化为Cu2+、Cu.并进行了以下实验.
ⅰ.将实验4反应后的试管静置,用胶头滴管吸出上层清液.
ⅱ.向下层浊液中加入过量稀硫酸,充分振荡、加热,应观察到的现象是溶液变为蓝色,有红色固体.
(5)小组同学继续查阅资料得知:Cu(OH)2可与OH-继续反应生成蓝紫色溶液([Cu(OH)4]2-),由此提出问题:[Cu(OH)4]2-能否与乙醛发生反应,生成红色沉淀?设计实验解决这一问题,合理的实验步骤是将1mL2%CuSO4溶液与3mL(或>3mL)10%NaOH溶液混合振荡后(或取实验5的蓝紫色溶液),加入0.5mL40%的乙醛溶液,水浴加热.基于上述实验,该小组同学获得结论:乙醛参与反应生成红色沉淀时,需控制体系的pH>10.
11.将15.6g Na2O2和5.4g Al同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72L,若反应过程中溶液的体积保持不变,则下列说法正确是( )
| A. | 标准状况下,反应过程中得到6.72L的气体 | |
| B. | 最终得到的溶液中c(Na+)=c(Cl-)+c(OH-) | |
| C. | 最终得到7.8 g的沉淀 | |
| D. | 最终得到的溶液中c(Na+)=1.5 mol•L-1 |
18.下列有关物质的性质或结构的说法中正确的是( )
| A. | L层上的电子数为奇数的原子不一定是主族元素的原子 | |
| B. | 只由共价键形成的物质不一定是共价化合物 | |
| C. | 化学键的形成一定伴随着电子的转移和能量变化 | |
| D. | 元素周期表中,位于金属和非金属分界线附近的元素属于过渡元素 |
15.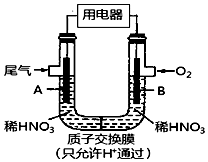 某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔导电材料.下列说法一定正确的是( )
某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔导电材料.下列说法一定正确的是( )
 某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔导电材料.下列说法一定正确的是( )
某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔导电材料.下列说法一定正确的是( )| A. | 该电池工作时,电子的流向外电路由A到B,内电路由B到A形成闭合回路 | |
| B. | 电极B附近的HNO3浓度增大 | |
| C. | A电极的反应为:NO2-e-+H2O═NO3-+2H+,NO-3e-+2H2O═NO3-+4H+ | |
| D. | 该电池工作时,每消耗11.2L O2(标准状况下),可以除去含1mol NO和NO2的混合尾气 |
16.仅用提供的硅酸盐仪器(非硅酸盐仪器任选),不能达到相应实验目的是( )
| A. | 提纯粗盐:烧杯、玻璃棒、酒精灯、蒸发皿、漏斗 | |
| B. | 中和热的测定:量筒、温度计、环形玻璃搅拌棒、胶头滴管 | |
| C. | 用CCl4提取碘水中的碘:分液漏斗、烧杯 | |
| D. | 用18.4 mol•L-1浓硫酸配制100mL 1.0 mol•L-1硫酸:10mL量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管 |