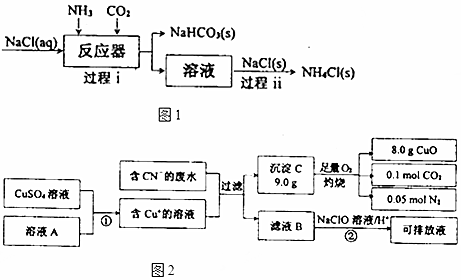
题目内容
16.下列化学用语使用科学规范的是( )| A. | 35Cl和37Cl的原子结构示意图均为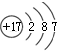 | |
| B. | HCI的形成过程为 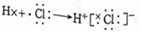 | |
| C. | 乙烯的结构简式为CH2CH2 | |
| D. | 草酸的电离过程为H2C2O4?2H++C2O42- |
分析 A.两种微粒都是氯原子,其原子结构示意图相同;
B.氯化氢为共价化合物,分子中不存在阴阳离子;
C.乙烯的结构简式中必须标出碳碳双键;
D.草酸为二元弱酸,其电离方程式需要分步书写.
解答 解:A.35Cl和37Cl核电荷数、核外电子总数都是17,二者的原子结构示意图均为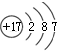 ,故A正确;
,故A正确;
B.HCl为共价化合物,电子式中不能标出阴阳离子,用电子式表示其形成过程为 ,故B错误;
,故B错误;
C.乙烯分子中含有碳碳双键,其正确的结构简式为:CH2=CH2,故C错误;
D.草酸的电离分步进行,主要以第一步为主,正确的电离方程式为:H2C2O4?H++HC2O4-,故D错误;
故选A.
点评 本题考查常见化学用语的表示方法,题目难度不大,涉及原子结构示意图、电子式、结构简式、电离方程式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.

练习册系列答案
相关题目
6.下列互为同位素的是( )
| A. | Na和Na+ | B. | 35Cl和37Cl | ||
| C. | 14N和 14C | D. | ${\;}_{8}^{16}$O2和${\;}_{8}^{18}$O2 |
4.相同条件下,下列碱溶液的pH值最大的是( )
| A. | 0.1mol/L氢氧化钠溶液 | B. | 0.1mol/L氢氧化钡溶液 | ||
| C. | 0.1mol/L氢氧化钾溶液 | D. | 0.1mol/L氨水 |
11.某一元弱酸HA溶液中,[H+]为0.2mol/L,未电离的HA浓度为1.8mol/L,则HA的电离度是( )
| A. | 10% | B. | 11.1% | C. | 0.1% | D. | 20% |
6.草酸是一种重要的试剂.下面是利用草酸探究浓度对反应速率影响的实验.
(1)为证明浓度对反应速率的影响,曾有教科书《化学反应原理》设计了如下实验:取两支试管,各加入4mL0.01mol•L-1的KMnO4酸性溶液,分别向其中加入0.1mol•L-1、0.2mol•L-1 H2C2O4溶液2mL,记录溶液褪色所需时间.
实验中发生反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
预期现象是:
①溶液的颜色由紫色变为无色,
②其中加入0.2mol•L-1H2C2O4的那支试管中的溶液先变色.
然而实验结果并不尽如人意.实验过程颜色复杂,且褪色先缓慢,后逐渐加快;最大的问题是草酸浓度大,反应速率却更慢.
本实验能否作为课堂实验研究浓度对化学反应速率的影响?适宜的条件是怎样的?某校一研究小组对此进行了探究.下面是他们的实验报告的一部分:
表1 试验安排及结果
应用SPSS16.0对正交试验结果进行方差分析,结果如表
表2 各因素水平的数据处理结果
(2)由表2可知,三因素中,C的浓度(选填“A、B或C”,下空同)对反应速率影响显著,而A和B的浓度对反应速率的影响不显著.
(3)由表2可知,当高锰酸钾浓度为0.005mol•L-1、草酸浓度为0.1mol•L-1时,反应最快.即因素A、B的较适宜实验条件得以确定.
根据以上实验结果,该小组同学继续探究硫酸的浓度是怎样影响本反应速率的,测得如下实验结果:
表3 不同硫酸浓度下的褪色时间
(4)根据课堂实验的合适时间,可选溶液的褪色时间约为1分钟和2分钟的两份溶液,即此时硫酸的浓度为18mol•L-1和10mol•L-1,这也有利于观察这两个反应速率的差异.
结论:草酸与酸性高锰酸钾溶液的反应,可作为课堂实验探究浓度对反应速率的影响.
(1)为证明浓度对反应速率的影响,曾有教科书《化学反应原理》设计了如下实验:取两支试管,各加入4mL0.01mol•L-1的KMnO4酸性溶液,分别向其中加入0.1mol•L-1、0.2mol•L-1 H2C2O4溶液2mL,记录溶液褪色所需时间.
实验中发生反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
预期现象是:
①溶液的颜色由紫色变为无色,
②其中加入0.2mol•L-1H2C2O4的那支试管中的溶液先变色.
然而实验结果并不尽如人意.实验过程颜色复杂,且褪色先缓慢,后逐渐加快;最大的问题是草酸浓度大,反应速率却更慢.
本实验能否作为课堂实验研究浓度对化学反应速率的影响?适宜的条件是怎样的?某校一研究小组对此进行了探究.下面是他们的实验报告的一部分:
表1 试验安排及结果
| 实验 编号 | A(KMnO4溶液浓度/mol•L-1) | B(草酸溶液浓度/mol•L-1) | C(硫酸溶液浓度/mol•L-1) | 褪色时间/s |
| 1 | 3 | 3 | 1 | 336 |
| 2 | 1 | 2 | 3 | 82 |
| 3 | 3 | 1 | 3 | 76 |
| 4 | 1 | 3 | 2 | 133 |
| 5 | 2 | 3 | 3 | 102 |
| 6 | 3 | 2 | 2 | 156 |
| 7 | 2 | 2 | 1 | 300 |
| 8 | 2 | 1 | 2 | 115 |
| 9 | 1 | 1 | 1 | 200 |
表2 各因素水平的数据处理结果
| A(KMnO4溶液) | B(草酸溶液) | C(硫酸溶液) | |||||||
| 浓度/mol•L-1 | 0.005 | 0.010 | 0.015 | 0.1 | 0.5 | 0.9 | 6 | 12 | 18 |
| 平均褪色时间/s | 138.3 | 172.3 | 189.3 | 130.3 | 179.3 | 190.3 | 278.7 | 134.7 | 86.7 |
(3)由表2可知,当高锰酸钾浓度为0.005mol•L-1、草酸浓度为0.1mol•L-1时,反应最快.即因素A、B的较适宜实验条件得以确定.
根据以上实验结果,该小组同学继续探究硫酸的浓度是怎样影响本反应速率的,测得如下实验结果:
表3 不同硫酸浓度下的褪色时间
| c(H2SO4)/mol•L-1 | 18 | 16 | 14 | 12 | 10 | 8 | 6 |
| 褪色时间/s | 67 | 83 | 90 | 103 | 129 | 146 | 200 |
结论:草酸与酸性高锰酸钾溶液的反应,可作为课堂实验探究浓度对反应速率的影响.
7.下列离子在指定溶液中一定能大量共存的是( )
| A. | 能使甲基橙变红的溶液中:Fe2+、Al3+、NO3-、Cl- | |
| B. | 在pH=12的溶液中:Na+、AlO2-、NO3-、S2- | |
| C. | 室温下,由水电离的c(H+)=10-10mol/L的溶液中:Cl-、HCO3-、NO3-、NH4+ | |
| D. | 加入Mg能放出H2的溶液中:Mg2+、NH4+、ClO-、K+ |
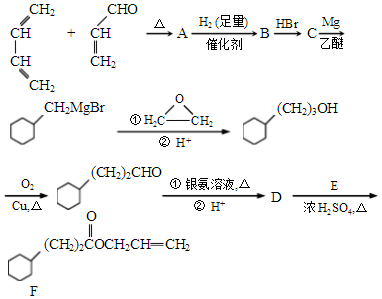
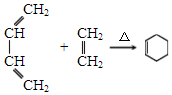
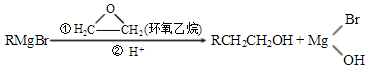
 ,A中所含官能团的名称是醛基、碳碳双键.
,A中所含官能团的名称是醛基、碳碳双键. .
.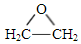 )为原料制备1丁醇,设计合成路线
)为原料制备1丁醇,设计合成路线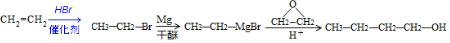 (其它试剂任选).(合成路线常用表示方法为:A $→_{反应条件}^{反应试剂}$ B …$→_{反应条件}^{反应试剂}$目标产物)
(其它试剂任选).(合成路线常用表示方法为:A $→_{反应条件}^{反应试剂}$ B …$→_{反应条件}^{反应试剂}$目标产物)
 同分异构体的结构简式.
同分异构体的结构简式.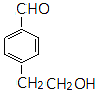 、
、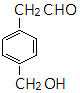 .
.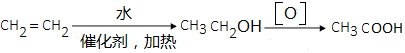 .(无机试剂可以任选)
.(无机试剂可以任选)