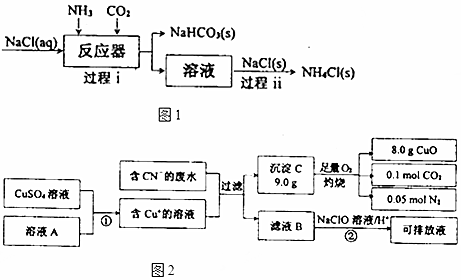
题目内容
13.最新研究表明,以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,下列有关说法正确的是( )| A. | 乙酸是非电解质 | |
| B. | 上述制备乙酸的化学方程式为CO2+CH4$\stackrel{Cu_{2}Al_{2}O_{2}}{→}$CH3COOH | |
| C. | 上述制备乙酸的反应中原子利用率为80% | |
| D. | 乙酸没有同分异构体 |
分析 A.乙酸在水溶液中存在电离平衡;
B.CO2和CH4直接转化成乙酸,遵循质量守恒定律;
C.反应产物只有一种;
D.乙酸与甲酸甲酯的分子式相同、结构不同.
解答 解:A.乙酸在水溶液中存在电离平衡,则乙酸为弱电解质,故A错误;
B.CO2和CH4直接转化成乙酸,遵循质量守恒定律,制备乙酸的化学方程式为CO2+CH4$\stackrel{Cu_{2}Al_{2}O_{2}}{→}$CH3COOH,故B正确;
C.反应产物只有一种,制备乙酸的反应中原子利用率为100%,故C错误;
D.乙酸与甲酸甲酯的分子式相同、结构不同,则二者互为同分异构体,乙酸有同分异构体,故D错误;
故选B.
点评 本题考查有机物制备的实验评价,为高频考点,把握制备原理、反应特点、同分异构体、电解质等为解答的关键,侧重分析与应用能力的考查,综合性较强,注意实验的评价性分析,题目难度不大.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案
相关题目
3.下列叙述错误的是( )
| A. | 乙烯和苯使溴水褪色的原因不同 | |
| B. | 苯和氢气在一定条件下生成环己烷的反应为还原反应 | |
| C. | 硝基苯和乙酸乙酯的制备都发生了取代反应 | |
| D. | 由乙醇制取乙烯发生了氧化反应 |
4.相同条件下,下列碱溶液的pH值最大的是( )
| A. | 0.1mol/L氢氧化钠溶液 | B. | 0.1mol/L氢氧化钡溶液 | ||
| C. | 0.1mol/L氢氧化钾溶液 | D. | 0.1mol/L氨水 |
6.草酸是一种重要的试剂.下面是利用草酸探究浓度对反应速率影响的实验.
(1)为证明浓度对反应速率的影响,曾有教科书《化学反应原理》设计了如下实验:取两支试管,各加入4mL0.01mol•L-1的KMnO4酸性溶液,分别向其中加入0.1mol•L-1、0.2mol•L-1 H2C2O4溶液2mL,记录溶液褪色所需时间.
实验中发生反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
预期现象是:
①溶液的颜色由紫色变为无色,
②其中加入0.2mol•L-1H2C2O4的那支试管中的溶液先变色.
然而实验结果并不尽如人意.实验过程颜色复杂,且褪色先缓慢,后逐渐加快;最大的问题是草酸浓度大,反应速率却更慢.
本实验能否作为课堂实验研究浓度对化学反应速率的影响?适宜的条件是怎样的?某校一研究小组对此进行了探究.下面是他们的实验报告的一部分:
表1 试验安排及结果
应用SPSS16.0对正交试验结果进行方差分析,结果如表
表2 各因素水平的数据处理结果
(2)由表2可知,三因素中,C的浓度(选填“A、B或C”,下空同)对反应速率影响显著,而A和B的浓度对反应速率的影响不显著.
(3)由表2可知,当高锰酸钾浓度为0.005mol•L-1、草酸浓度为0.1mol•L-1时,反应最快.即因素A、B的较适宜实验条件得以确定.
根据以上实验结果,该小组同学继续探究硫酸的浓度是怎样影响本反应速率的,测得如下实验结果:
表3 不同硫酸浓度下的褪色时间
(4)根据课堂实验的合适时间,可选溶液的褪色时间约为1分钟和2分钟的两份溶液,即此时硫酸的浓度为18mol•L-1和10mol•L-1,这也有利于观察这两个反应速率的差异.
结论:草酸与酸性高锰酸钾溶液的反应,可作为课堂实验探究浓度对反应速率的影响.
(1)为证明浓度对反应速率的影响,曾有教科书《化学反应原理》设计了如下实验:取两支试管,各加入4mL0.01mol•L-1的KMnO4酸性溶液,分别向其中加入0.1mol•L-1、0.2mol•L-1 H2C2O4溶液2mL,记录溶液褪色所需时间.
实验中发生反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
预期现象是:
①溶液的颜色由紫色变为无色,
②其中加入0.2mol•L-1H2C2O4的那支试管中的溶液先变色.
然而实验结果并不尽如人意.实验过程颜色复杂,且褪色先缓慢,后逐渐加快;最大的问题是草酸浓度大,反应速率却更慢.
本实验能否作为课堂实验研究浓度对化学反应速率的影响?适宜的条件是怎样的?某校一研究小组对此进行了探究.下面是他们的实验报告的一部分:
表1 试验安排及结果
| 实验 编号 | A(KMnO4溶液浓度/mol•L-1) | B(草酸溶液浓度/mol•L-1) | C(硫酸溶液浓度/mol•L-1) | 褪色时间/s |
| 1 | 3 | 3 | 1 | 336 |
| 2 | 1 | 2 | 3 | 82 |
| 3 | 3 | 1 | 3 | 76 |
| 4 | 1 | 3 | 2 | 133 |
| 5 | 2 | 3 | 3 | 102 |
| 6 | 3 | 2 | 2 | 156 |
| 7 | 2 | 2 | 1 | 300 |
| 8 | 2 | 1 | 2 | 115 |
| 9 | 1 | 1 | 1 | 200 |
表2 各因素水平的数据处理结果
| A(KMnO4溶液) | B(草酸溶液) | C(硫酸溶液) | |||||||
| 浓度/mol•L-1 | 0.005 | 0.010 | 0.015 | 0.1 | 0.5 | 0.9 | 6 | 12 | 18 |
| 平均褪色时间/s | 138.3 | 172.3 | 189.3 | 130.3 | 179.3 | 190.3 | 278.7 | 134.7 | 86.7 |
(3)由表2可知,当高锰酸钾浓度为0.005mol•L-1、草酸浓度为0.1mol•L-1时,反应最快.即因素A、B的较适宜实验条件得以确定.
根据以上实验结果,该小组同学继续探究硫酸的浓度是怎样影响本反应速率的,测得如下实验结果:
表3 不同硫酸浓度下的褪色时间
| c(H2SO4)/mol•L-1 | 18 | 16 | 14 | 12 | 10 | 8 | 6 |
| 褪色时间/s | 67 | 83 | 90 | 103 | 129 | 146 | 200 |
结论:草酸与酸性高锰酸钾溶液的反应,可作为课堂实验探究浓度对反应速率的影响.
3.关于下列关于周期表的描述正确的是( )
| A. | 副族元素中没有非金属 | |
| B. | 除短周期外,其他周期均有18种元素 | |
| C. | ⅠA族的所有元素都为金属元素 | |
| D. | 同周期ⅡA族与ⅢA族元素原子序数相差只有1、11 |
4.根据下列实验操作和现象所得到的结论正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 测定等浓度的Na2CO2和Na2SO3溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
| B | 向氯水中滴加少量品红溶液 | 品红溶液褪色 | Cl2有漂白性 |
| C | 向等浓度的KCI、KI混合液中滴加AgNO3溶液 | 先出现黄色沉淀 | Kap(AgCl)<Kap(AgI) |
| D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 下层液体呈紫红色 | 氧化性:Fe3+>I2 |
| A. | A | B. | B | C. | C | D. | D |

 同分异构体的结构简式.
同分异构体的结构简式.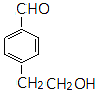 、
、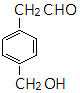 .
.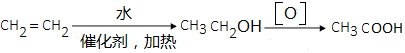 .(无机试剂可以任选)
.(无机试剂可以任选)