��Ŀ����
11����15.6g Na2O2��5.4g Alͬʱ����һ������ˮ�У���ַ�Ӧ��õ�200mL��Һ���������Һ�л���ͨ���״���µ�HCl����6.72L������Ӧ��������Һ��������ֲ��䣬������˵����ȷ�ǣ�������| A�� | ��״���£���Ӧ�����еõ�6.72L������ | |
| B�� | ���յõ�����Һ��c��Na+��=c��Cl-��+c��OH-�� | |
| C�� | ���յõ�7.8 g�ij��� | |
| D�� | ���յõ�����Һ��c��Na+��=1.5 mol•L-1 |
���� 15.6gNa2O2�����ʵ���Ϊ��$\frac{15.6g}{78g/mol}$=0.2mol��5.4gAl�����ʵ���Ϊ��$\frac{5.4g}{27g/mol}$=0.2mol�����ȷ�����Ӧ2Na2O2+2H2O�T4NaOH+O2��������NaOHΪ0.4mol���ٷ���2Al+2NaOH+2H2O�T2NaAlO2+3H2�����ɷ���ʽ��֪Al��ȫ��Ӧ��ʣ��NaOHΪ0.4mol-0.2mol=0.2mol������NaAlO2Ϊ0.2mol��ͨ���״���µ�HCl����6.72L�����ʵ���Ϊ��$\frac{6.72L}{22.4L/mol}$=0.3mol�����ȷ�����ӦNaOH+HCl�TNaCl+H2O��ʣ��HClΪ0.3mol-0.2mol=0.1mol���ٷ�����ӦNaAlO2+HCl+H2O�TAl��OH��3��+NaCl���ɷ���ʽ��֪��NaAlO2��ʣ�࣬HCl��ȫ��Ӧ������Al��OH��3Ϊ0.1mol��������Һ������ΪNaAlO2��NaCl��
A�����ݹ���������ˮ��Ӧ�������������Ʒ�Ӧ���������������������������
B��������Һ������ΪNaAlO2��NaCl�����ݵ���غ��֪c��Na+��+c��H+��=c��Cl-��+c��AlO2-��+c��OH-����
C������m=nM�������ɵ�����������������
D�������������غ��֪��Ӧ����Һ��n��Na+��=2n��Na2O2�����ٸ���c=$\frac{n}{V}$���㣮
��� �⣺15.6gNa2O2�����ʵ���Ϊ��$\frac{15.6g}{78g/mol}$=0.2mol��5.4gAl�����ʵ���Ϊ��$\frac{5.4g}{27g/mol}$=0.2mol�����ȷ�����Ӧ2Na2O2+2H2O�T4NaOH+O2��������NaOHΪ0.4mol���ٷ���2Al+2NaOH+2H2O�T2NaAlO2+3H2�����ɷ���ʽ��֪Al��ȫ��Ӧ��ʣ��NaOHΪ0.4mol-0.2mol=0.2mol������NaAlO2Ϊ0.2mol��ͨ���״���µ�HCl����6.72L�����ʵ���Ϊ��$\frac{6.72L}{22.4L/mol}$=0.3mol�����ȷ�����ӦNaOH+HCl�TNaCl+H2O��ʣ��HClΪ0.3mol-0.2mol=0.1mol���ٷ�����ӦNaAlO2+HCl+H2O�TAl��OH��3��+NaCl���ɷ���ʽ��֪��NaAlO2��ʣ�࣬HCl��ȫ��Ӧ������Al��OH��3Ϊ0.1mol��������Һ������ΪNaAlO2��NaCl��
A������������ˮ��Ӧ��������Ϊ0.2mol��$\frac{1}{2}$=0.1mol�������������Ʒ�Ӧ��������Ϊ0.2mol��$\frac{3}{2}$=0.3mol�����������������Ϊ��0.1mol+0.3mol����22.4L/mol=8.96L����A����
B����Ӧ����Һ�ijɷ���0.3molNaCl��0.1molNaAlO2���ɵ���غ��֪c��Na+��=c��Cl-��+c��OH-��+c��AlO2-��-c��H+������B����
C����������Al��OH��3Ϊ0.1mol������Ϊ0.1mol��78g/mol=7.8g����C��ȷ��
D�������������غ��֪����Ӧ����Һ��n��Na+��=2n��Na2O2��=2��0.2mol=0.4mol������Һ�Ȼ��Ƶ����ʵ���Ũ��Ϊ$\frac{0.4mol}{0.2L}$=2mol/L����D����
��ѡC��
���� ���⿼������ļ��㡢�ƵĻ������������ʼ�����������ʵȣ��Ѷ��еȣ����ݹ��������жϷ����ķ�Ӧ�ǽ���Ĺؼ�������������ѧ���Ļ�ѧ����������

| A�� | SiO2$\stackrel{HCl��aq��}{��}$SiCl4$\frac{{H}_{2}}{����}$Si | |
| B�� | MgCO3$\stackrel{HCl��aq��}{��}$MgCl2��aq��$\stackrel{���}{��}$Mg | |
| C�� | N2$��_{���¡���ѹ������}^{H_{2}}$NH${\;}_{{\;}_{3}}$$\stackrel{HCl��aq��}{��}$NH4Cl��aq�� | |
| D�� | FeS$\stackrel{HCl��aq��}{��}$H2S$��_{����}^{O_{2}}$SO2$��_{��ȼ}^{����}$H2SO4 |
��1��Ϊ֤��Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죬���н̿��顶��ѧ��Ӧԭ�������������ʵ�飺ȡ��֧�Թܣ�������4mL0.01mol•L-1��KMnO4������Һ���ֱ������м���0.1mol•L-1��0.2mol•L-1 H2C2O4��Һ2mL����¼��Һ��ɫ����ʱ�䣮
ʵ���з�����Ӧ�����ӷ���ʽΪ2MnO4-+5H2C2O4+6H+=2Mn2++10CO2��+8H2O��
Ԥ�������ǣ�
����Һ����ɫ����ɫ��Ϊ��ɫ��
�����м���0.2mol•L-1H2C2O4����֧�Թ��е���Һ�ȱ�ɫ��
Ȼ��ʵ���������������⣮ʵ�������ɫ���ӣ�����ɫ�Ȼ��������ӿ죻���������Dz���Ũ�ȴ�Ӧ����ȴ������
��ʵ���ܷ���Ϊ����ʵ���о�Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죿���˵������������ģ�ijУһ�о�С��Դ˽�����̽�������������ǵ�ʵ�鱨���һ���֣�
��1�����鰲�ż����
| ʵ�� ��� | A��KMnO4��ҺŨ��/mol•L-1�� | B��������ҺŨ��/mol•L-1�� | C��������ҺŨ��/mol•L-1�� | ��ɫʱ��/s |
| 1 | 3 | 3 | 1 | 336 |
| 2 | 1 | 2 | 3 | 82 |
| 3 | 3 | 1 | 3 | 76 |
| 4 | 1 | 3 | 2 | 133 |
| 5 | 2 | 3 | 3 | 102 |
| 6 | 3 | 2 | 2 | 156 |
| 7 | 2 | 2 | 1 | 300 |
| 8 | 2 | 1 | 2 | 115 |
| 9 | 1 | 1 | 1 | 200 |
��2��������ˮƽ�����ݴ������
| A��KMnO4��Һ�� | B��������Һ�� | C��������Һ�� | |||||||
| Ũ��/mol•L-1 | 0.005 | 0.010 | 0.015 | 0.1 | 0.5 | 0.9 | 6 | 12 | 18 |
| ƽ����ɫʱ��/s | 138.3 | 172.3 | 189.3 | 130.3 | 179.3 | 190.3 | 278.7 | 134.7 | 86.7 |
��3���ɱ�2��֪�����������Ũ��Ϊ0.005mol•L-1������Ũ��Ϊ0.1mol•L-1ʱ����Ӧ��죮������A��B�Ľ�����ʵ����������ȷ����
��������ʵ��������С��ͬѧ����̽�������Ũ��������Ӱ�챾��Ӧ���ʵģ��������ʵ������
��3����ͬ����Ũ���µ���ɫʱ��
| c��H2SO4��/mol•L-1 | 18 | 16 | 14 | 12 | 10 | 8 | 6 |
| ��ɫʱ��/s | 67 | 83 | 90 | 103 | 129 | 146 | 200 |
���ۣ����������Ը��������Һ�ķ�Ӧ������Ϊ����ʵ��̽��Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죮
 ����ͼ��ʾװ�ó�ȥ��CN-��CI-��ˮ�е�CN-ʱ��������ҺpHΪ9-10������������ClO-��CN-����Ϊ��������Ⱦ�����壬����˵������ȷ���ǣ�������
����ͼ��ʾװ�ó�ȥ��CN-��CI-��ˮ�е�CN-ʱ��������ҺpHΪ9-10������������ClO-��CN-����Ϊ��������Ⱦ�����壬����˵������ȷ���ǣ�������| A�� | ��ʯī���������������� | |
| B�� | �����ĵ缫��ӦʽΪ��Cl-+2OH--2e-�TClO-+H2O | |
| C�� | �����ĵ缫��ӦʽΪ��2H++2e-=H2�� | |
| D�� | ��ȥCN-�ķ�Ӧ��2CN-+5ClO-+2H+�TN2��+2CO2��+5Cl-+H2O |
| A�� | ����Ԫ����û�зǽ��� | |
| B�� | ���������⣬�������ھ���18��Ԫ�� | |
| C�� | ��A�������Ԫ�ض�Ϊ����Ԫ�� | |
| D�� | ͬ���ڢ�A�����A��Ԫ��ԭ���������ֻ��1��11 |

| A�� | ���л���ķ���ʽΪ��C6H6O6 | |
| B�� | ���л�������к������ֹ����� | |
| C�� | ���л�����ʹ����KMnO4��Һ��������Ȼ�̼��Һ��ɫ����ԭ����ͬ | |
| D�� | ��ͬ�����£�������˳ʽ��ͷ��ֱ���������NaHCO3��Na��Ӧ����������������Ϊ2��1 |

 ͬ���칹��Ľṹ��ʽ��
ͬ���칹��Ľṹ��ʽ��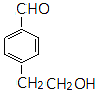 ��
��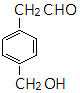 ��
�� �������Լ�������ѡ��
�������Լ�������ѡ��