题目内容
17.铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如图.若上端开口关闭,可得到强还原性的H•(氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的•OH(羟基自由基).下列说怯错误的是( )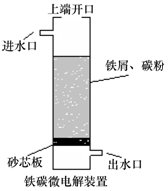
| A. | 无论是否鼓入空气,负极的电极反应式均为Fe-2e-═Fe2+ | |
| B. | 不鼓入空气时,正极的电极反应式为H++e-═H | |
| C. | 鼓入空气时,每生成1mol•OH有2mol电子发生转移 | |
| D. | 处理含有草酸(H2C2O4)的污水时,上端开口应打开并鼓入空气 |
分析 A.无论是否鼓入空气,Fe易失电子生成亚铁离子而作负极;
B.不鼓入空气时,正极上可得到强还原性的H•(氢原子);
C.若上端开口打开,并鼓入空气,可得到强氧化性的•OH(羟基自由基),O元素化合价由0价变为-2价;
D.处理含有草酸(H2C2O4)的污水时,因为草酸具有还原性,所以不能得到强氧化性的•OH(羟基自由基),应该得到强还原性的H•(氢原子).
解答 解:A.无论是否鼓入空气,Fe易失电子生成亚铁离子而作负极,电极反应式为Fe-2e-═Fe2+,故A正确;
B.不鼓入空气时,正极上可得到强还原性的H•(氢原子),电极反应式为H++e-═H,故B正确;
C.若上端开口打开,并鼓入空气,可得到强氧化性的•OH(羟基自由基),O元素化合价由0价变为-2价,所以鼓入空气时,每生成1mol•OH有2mol电子发生转移,故C正确;
D.处理含有草酸(H2C2O4)的污水时,因为草酸具有还原性,所以不能得到强氧化性的•OH(羟基自由基),应该得到强还原性的H•(氢原子),所以应该上端开口关闭,故D错误;
故选D.
点评 本题考查原电池原理,为高频考点,侧重考查学生获取信息、加工信息解答问题能力,明确化学反应原理、题给信息是解本题关键,题目难度不大.

练习册系列答案
相关题目
3.化学在生产、生活中有着广泛的应用,下列叙述不合理的是( )
| A. | 晶体硅熔点高,可制玻璃仪器 | B. | NaHCO3受热分解,可焙制糕点 | ||
| C. | N2化学性质稳定,可作保护气 | D. | 明矾易水解生成胶体,可作净水剂 |
2.某地海水中主要离子的含量如表:
利用电渗析法技术可将海水淡化,其原理如图所示,其中阴(阳)离子交换膜只允许阴(阳)离子通过,下列说法中不正确的是( )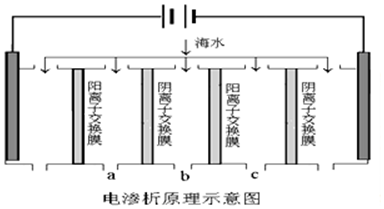
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含最/mg•L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |

| A. | 电解一段时间后阴极区会发生反应:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| B. | 阳极的电极反应式为2H2O-4e-═O2↑+4H+ | |
| C. | 电解时b室中阴离子移向a室,阳离子移向c室 | |
| D. | 淡水的出口为b出口 |
9.X、Y、Z、W是原子序数依次增大的不同主族短周期元素,其中两种为金属元素,X原子的最外层电子数与次外层电子数相等,X与W、Y与Z这两对原子的最外层电子数之和均为9.下列说法正确的是( )
| A. | Y、Z、W的简单离子半径Z>W>Y | B. | 工业上制取Y可用电解YW3制得 | ||
| C. | XW2中各原子均达到8电子结构 | D. | Z、W的氧化物对应水化物的酸性Z<W |
6.多巴胺的一种合成路线如图所示:

下列说法正确的是( )

下列说法正确的是( )
| A. | 原料甲与苯酚互为同系物 | |
| B. | 中间产物乙、丙和多巴胺都具有两性 | |
| C. | 多巴胺不可能存在氨基酸类的同分异构体 | |
| D. | 1 mol甲最多可以和2 mol Br2发生取代反应 |
7.已知1-18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,则下列叙述或表示方法正确的是( )
| A. | 四种元素位于同一周期 | B. | 氢化物的稳定性:H2Y>HZ | ||
| C. | 原子序数a>b>d>c | D. | a+3=c-2 |

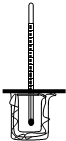 如图所示,大烧杯中放入一小烧杯,两烧杯间空隙用碎纸屑填充,小烧杯上方悬挂一温度计,两烧杯口共盖一泡沫塑料,构成一套简易测量温度变化装置.
如图所示,大烧杯中放入一小烧杯,两烧杯间空隙用碎纸屑填充,小烧杯上方悬挂一温度计,两烧杯口共盖一泡沫塑料,构成一套简易测量温度变化装置.