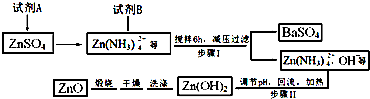
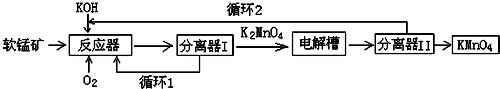
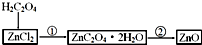题目内容
6.某学生设计如下实验装置利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题: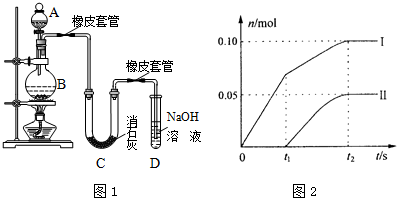
(1)A仪器的名称是分液漏斗,D的作用吸收尾气.
(2)漂白粉将在U型管中产生,其化学反应方程式是2Cl2 +2Ca(OH)2=CaCl2 +Ca(ClO)2 +2H2O.
(3)有同学建议在两个橡皮套管内的玻璃管口应尽量紧靠,原因是Cl2易腐蚀橡皮塞
(4)此实验结果所得Ca(ClO)2产率太低.经分析并查阅资料发现主要原因是在U型管中存在两个副反应:
①温度较高时氯气与消石灰反应生成了Ca(ClO3)2,为避免此副反应的发生,可采取的措施是将U型管置于冷水浴中,有同学测出了反应后溶液中ClO-、ClO3-两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为下图(不考虑氯气和水的反应).
a、图中曲线I表示ClO-离子的物质的量随反应时间变化的关系.
b、所取石灰乳中含有Ca(OH)2的物质的量为0.25mol.
c、另取一份等物质的量的石灰乳,以较大的速率通入足量氯气,反应后测得产物中Cl-的物质的量为0.37mol,则产物中n(ClO-)/n(ClO3-)=7:6
②试判断另一个副反应是(写出此反应方程式)2HCl+Ca(OH)2=CaCl2+2H2O.
分析 (1)由仪器图形可判断仪器名称,二氧化锰和浓盐酸在加热条件下生成氯气,氯气和分别与氢氧化钙、氢氧化钠溶液反应;
(2)工业制取漂白粉的反应原理书写反应的化学方程式;
(3)在两个橡皮套管内的玻璃管口应尽量紧靠,因为氯气是强氧化剂能氧化橡胶管;
(4)①因为温度高时易生成Ca(ClO3)2,所以避免此反应发生可以采取降温措施;
a、当温度低时,氯气和氢氧化钙反应生成氯化钙和次氯酸钙;当温度高时,生成氯酸钙和氯化钙,根据温度高低来判断属于哪种离子;
b、根据氧化还原反应中得失电子数相等计算氯离子的物质的量,然后根据含氯化合物中钙离子和阴离子的个数比计算氢氧化钙的物质的量;
c、另取一份与②等物质的量的石灰乳,以较大的速率通入足量氯气,反应后测得产物中Cl-的物质的量为0.37mol,依据氯化钙、次氯酸钙、氯酸钙中钙离子和含氯元素的物质的量比为1:2,结合b计算得到氢氧化钙物质的量计算氯元素物质的量,依据氧化还原反应电子守恒,生成产物中氯元素守恒列式计算;
②装置中无氯气的除杂装置,挥发出的氯化氢会和氢氧化钙反应.
解答 解:(1)装置中添加浓盐酸通过分液漏斗;氯气有毒,不能排放到空气中,氢氧化钠溶液的作用是吸收过量的氯气;故答案为:分液漏斗;吸收尾气;
(2)漂白粉将在U形管中产生,是氯气和氢氧化钙反应生成氯化钙、次氯酸钙、水;其化学方程式为:2Cl2 +2Ca(OH)2=CaCl2 +Ca(ClO)2 +2H2O;
故答案为:2Cl2 +2Ca(OH)2=CaCl2 +Ca(ClO)2 +2H2O;
(3)Cl2易腐蚀橡皮塞,在两个橡皮套管内的玻璃管口应尽量紧靠,故答案为:Cl2易腐蚀橡皮塞;
(4)①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,用冰水或冷水冷却;
a、当温度低时,氯气和氢氧化钙反应生成氯化钙和次氯酸钙;当温度高时,生成氯酸钙和氯化钙,刚开始反应时,温度较低,氯气和氢氧化钙反应生成氯化钙和次氯酸钙,所以图2中曲线I表示离子ClO-的物质的量随反应时间变化的关系;
b、根据氧化还原反应中得失电子数相等计算氯离子的物质的量,设氯离子的物质的量为n,则n×1=0.10mol×1+0.05mol×5=0.35mol,含氯元素的物质的量=0.35mol+0.1mol+0.05mol=0.5mol,氯化钙、次氯酸钙、氯酸钙中钙离子和含氯离子的个数比为1:2,所以所取石灰乳中含有Ca(OH)2的物质的量为0.25mol;
c、取一份与②等物质的量的石灰乳,物质的量为0.25mol,根据氧化还原反应中得失电子数相等,生成氯离子得到电子和生成次氯酸根和氯酸根失去的电子守恒,设n(ClO-)=x,n(ClO3-)=y;则得到:①0.37=x×1+y×5;依据氯化钙、次氯酸钙、氯酸钙中钙离子和含氯元素的物质的量比为1:2,得到氯元素物质的量为0.5mol;②x+y+0.37=0.5;①②联立得到:
x=0.07mol,y=0.06mol;则n(ClO-)/n(ClO3-)=7:6;
故答案为:将U型管置于冷水浴中;ClO-;0.25;7:6;
②装置中无氯气的除杂装置,挥发出的氯化氢会和氢氧化钙反应,反应的化学方程式为:2HCl+Ca(OH)2=CaCl2+2H2O,
故答案为:2HCl+Ca(OH)2=CaCl2+2H2O.
点评 本题考查了实验室制漂白粉的装置分析和制备条件判断,为高考常见题型,侧重于学生的分析能力和实验能力的考查,温度不同产物不同,图象分析是解题关键,通过氧化还原反应的电子守恒计算应用是解题关键,实验装置和步骤的分析需要熟练掌握实验基本操作,题目难度较大.

 全优点练单元计划系列答案
全优点练单元计划系列答案| A. | 一定温度、压强下,气体体积由其物质的量的多少决定 | |
| B. | 两种物质的物质的量相同,则它们在标准状况下的体积相同 | |
| C. | 同温同压下,气体的密度与气体的相对分子质量成正比 | |
| D. | 同温同体积时,气体物质的物质的量越大,则压强越大 |
| A. | 58.5g NaCl含有NA个分子 | |
| B. | 1mol N2和3mol H2充分反应,有6NA电子转移 | |
| C. | 标准状况下,22.4LCHCl3含有分子数为NA | |
| D. | 46g NO2和N2O4混合气体含有的原子数为3NA |
| 相对分子质量 | 熔点/℃ | 沸点/℃ | 密度/(g.cm-3) | 水溶性 | |
| 苯甲酸 | 122 | 122.4 | 249 | 1.2659 | 微溶 |
| 甲醇 | 32 | -97 | 64.6 | 0.792 | 互溶 |
| 苯甲酸甲酯 | 136 | -12.3 | 196.6 | 1.0888 | 不溶 |
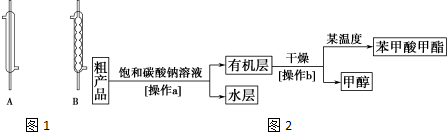
(1)实验中,应选择(如图1)B(填序号)作为冷凝回流装置,该仪器的名称为球形冷凝管.
(2)使用过量甲醇的原因是甲醇沸点低,损失大;甲醇过量可以提高苯甲酸的利用率.
Ⅱ.粗产品的精制 苯甲酸甲酯粗产品中往往含有少量甲醇、苯甲酸和水等,现拟用下列流程图2进行精制.
(3)饱和碳酸钠溶液的作用是除去苯甲酸甲酯中的杂质苯甲酸,溶解甲醇,降低苯甲酸甲酯溶解度,操作a的名称为分液.
(4)由于有机层和水层的密度比较接近,兴趣小组的同学无法直接判断有机层在上层还是下层,请你设计简单易行的方案,简述实验方法,可能的现象及结论从分液漏斗下口放出少量液体,置于试管中,加入适量水,振荡、静置,若液体分层,则有机层在下层,若液体不分层,则有机层在上层.
(5)该实验中制得苯甲酸甲酯8.30g,则苯甲酸甲酯的产率为61.0%.
| A. | 提高硫酸亚铁的溶解度 | B. | 防止硫酸亚铁分解 | ||
| C. | 抑制硫酸亚铁水解 | D. | 稀硫酸防止硫酸亚铁被氧化 |
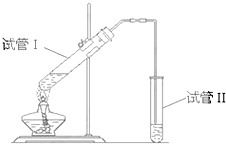 如图所示装置,该装置用于制备少量乙酸乙酯,请回答:
如图所示装置,该装置用于制备少量乙酸乙酯,请回答: