��Ŀ����
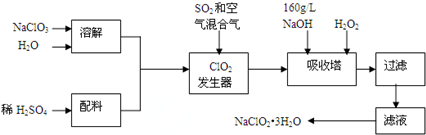
11������ZnO�ڴ���ҽҩ�����²��Ϸ����й�����Ӧ��ǰ�����������Ʊ�����ZnO����ع������̣��Իش��й����⣺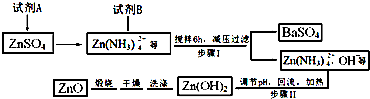
��֪��Ksp[Zn��OH��2]=4.5��10-17����Zn��OH��2�������ԣ�
��1���Լ�A�ǰ�ˮ���Լ�B��Ba��OH��2������I����BaSO4�����ӷ���ʽ��Ba2++SO42-=BaSO4����
��2������II�У�pHӦ������c������ţ���
a��3��5 b��5 c��8��9 d��12��14
��3������II�С�������ʱ�����õ����������е�d������ţ���
a����Һ©�� b���¶ȼ� c������������ d������������
��4����֪����ʵ��������200mL 0.25mol/L ZnSO4��Һ��50mL 8mol/L���Լ�A
��Ӧ�����������Լ�B������Ϊ8.6g������������С�����һλ����
��5������II�ڼ��Ȼ�����ͬʱ��Ҫ�������������������ƣ��������ʿ�ѭ��ʹ�ã�
��6������ZnOҲ���������������Ʊ������з�Ӧ������������̼�Ļ������
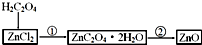
��д��صĻ�ѧ����ʽ��H2C2O4+ZnCl2+2H2O=ZnC2O4•2H2O+2HCl����ZnC2O4•2H2O=ZnO+CO��+CO2��+2H2O��
���� ����п�����Լ�AΪ��ˮ�õ�п�������ӣ������Լ�B���裬��ѹ���ˣ��õ����ᱵ������Zn��NH3��42-��OH-�ȣ�������ҺPH�������ȹ��ˣ��õ�������п������ϴ�Ӻ�ɸ��ﱺ�յõ�����п��
��1��������֪�Լ�AΪ��ˮ���Լ�BΪ����������Һ��������DZ����Ӻ���������ӽ���������ᱵ������
��2������II�У�pHӦ���ڵ�п����ȫ������������ܶȻ�����������Һ��PH�жϣ�
��3������II�С�������ʱ��Ҫ����װ�ã����������ܣ�ֱ����������Ҫ����������ʱʹ�ã���������ͷ�����������е㳬��140��ʱ��һ��ʹ�ÿ��������ܣ�����ֱ��������ͨˮ��ȴ���²����²���ը�ѣ�������������Ҫ���ڻ��������������������ط�Ӧ��ϵ�����������ֱ�������ܴ�����Ч���Ըߣ�
��4���������BΪ���������������Ӻ���������ӽ����������ᱵ���������������������ʵ������ڱ��������ʵ�����������������������
��5������II�ڼ��Ȼ�����ͬʱ�ѷ�Ӧ���ɵİ�������������ѭ��ʹ�ã�
��6��������Ȼ�п��Һ��Ӧ���ɲ���п�ᾧˮ�������п����ֽ���������п������������̼�Ļ�����Ϊһ����̼��������̼��Ԫ���غ�õ�ˮ������ԭ���غ���ƽ��д��ѧ����ʽ��
��� �⣺����п�����Լ�AΪ��ˮ�õ�п�������ӣ������Լ�B���裬��ѹ���ˣ��õ����ᱵ������Zn��NH3��42-��OH-�ȣ�������ҺPH�������ȹ��ˣ��õ�������п������ϴ�Ӻ�ɸ��ﱺ�յõ�����п��
��1��������֪�Լ�AΪ��ˮ���Լ�BΪ����������Һ��������DZ����Ӻ���������ӽ���������ᱵ�������Լ�AΪ����ˮ���Լ�BΪBa��OH��2������I����BaSO4�����ӷ���ʽ��Ba2++SO42-=BaSO4����
�ʴ�Ϊ����ˮ��Ba��OH��2��Ba2++SO42-=BaSO4����
��2������ܶȻ�����������Һ��PH��Ksp[Zn��OH��2]=c��Zn2+��c2��OH-��=4.5��10-17��c��OH-��=$\root{3}{4.5��1{0}^{-17}}$=3.6��10-6mol/L��c��H+��=$\frac{1{0}^{-14}}{3.6��1{0}^{-6}}$=2.8��10-9mol/L��PH=-lg2.8��10-9=9-0.5=8.5������II�У�pHӦ���ڣ�8.5п����ȫ����������ѡc��
�ʴ�Ϊ��c��
��3������II�С�������ʱ��Ҫ����װ�ã�������������Ҫ���ڻ��������������������ط�Ӧ��ϵ����������ϴ�����Ч���Ըߣ��ʴ�Ϊ��d��
��4���������BΪ���������������Ӻ���������ӽ���������ᱵ������������������ʵ������ڱ��������ʵ�������������������������ʵ��������200mL 0.25mol/L ZnSO4��Һ��50mL 8mol/L���Լ�Ϊ��ˮ��Ӧ��������������ʵ���=���ᱵ���ʵ���=�����������ʵ���=0.200L��0.25mol/L=0.05mol�����������Լ���������������=0.05mol��171g/mol=8.6g���ʴ�Ϊ��8.6g��
��5������II�ڼ��Ȼ�����ͬʱ�ѷ�Ӧ���ɵİ�������������ѭ��ʹ�ã��ʴ�Ϊ��������
��6��������Ȼ�п��Һ��Ӧ���ɲ���п�ᾧˮ�����ѧ����ʽΪ��H2C2O4+ZnCl2+2H2O=ZnC2O4•2H2O+2HCl������п����ֽ���������п������������̼�Ļ�����Ϊһ����̼��������̼��Ԫ���غ�õ�ˮ������ԭ���غ���ƽ��д��ѧ����ʽΪZnC2O4•2H2O=ZnO+CO��+CO2��+2H2O��
�ʴ�Ϊ��H2C2O4+ZnCl2+2H2O=ZnC2O4•2H2O+2HCl��ZnC2O4•2H2O=ZnO+CO��+CO2��+2H2O��
���� ���⿼���������Ʊ���ʵ����̷������������ʡ�ʵ�������������Ӧ���������֪ʶ�㣬���ջ����ǽ���ؼ�����Ŀ�Ѷ��еȣ�

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| A�� | ��״���£�22.4L HF�к��з�ԭ����ĿΪNA | |
| B�� | 0.1mol/L��NH4HSO4��Һ�еμ�0.1mol/L��Ba��OH��2��Һ�������պ���ȫ��c��NH4+����c��OH-����c��SO42-����c��H+�� | |
| C�� | 1mol ��ͼ������Ũ��ˮ��Ӧʱͨ���������Br2Ϊ6mol | |
| D�� | 12gʯīϩ������ʯī���к�����Ԫ���ĸ���Ϊ0.5NA |
| A�� | ����ˮ��Ӧ��Na+2H2O=Na++2OH-+H2�� | |
| B�� | ̼������Һ�м������ʯ��ˮ��Ca��OH��2+CO32-=CaCO3��+2OH- | |
| C�� | ����������Һ��ͨ�����CO2��OH-+CO2=HCO3- | |
| D�� | FeCl3��Һ��Cu��Ӧ��Cu+Fe3+=Cu2++Fe2+ |
| A�� | ��֪2C��s��+O2��g��=2CO��g����H=-221 kJ•mol-1�����֪C�ı�ȼ����Ϊ110.5 kJ•mol-1 | |
| B�� | ��101KPa�������ı�ȼ���ȡ�H=-285.5 kJ•mol-1����ˮ�ֽ���Ȼ�ѧ����ʽ��2H2O��l��=2H2��g��+O2��g����H=+285.5 kJ•mol-1 | |
| C�� | ϡ������0.1 mol/LNaOH��Һ��Ӧ��H+��aq��+OH-��aq��=H2O��l����H=-57.3 kJ•mol-1 | |
| D�� | �ܱ������У�9.6 g�����11.2 g���ۻ�ϼ�������������17.6 gʱ���ų�19.12 kJ��������Fe��s��+S��g��=FeS��s����H=-95.6 kJ•mol-1 |
 ��
��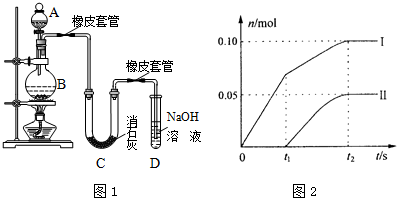

 ���������ӷ���ʽΪBr-+Ag+�TAgBr����
���������ӷ���ʽΪBr-+Ag+�TAgBr���� ��Br2��Ҫ��õ������IJ������NaOH��Һ�Լ�ϴ�ӣ�ϴ�Ӻ����ֲ�ƷӦʹ�õ������Ƿ�Һ©����
��Br2��Ҫ��õ������IJ������NaOH��Һ�Լ�ϴ�ӣ�ϴ�Ӻ����ֲ�ƷӦʹ�õ������Ƿ�Һ©����