题目内容
8.设NA为阿伏加德罗常数的数值,下列说法正确的是( )| A. | 58.5g NaCl含有NA个分子 | |
| B. | 1mol N2和3mol H2充分反应,有6NA电子转移 | |
| C. | 标准状况下,22.4LCHCl3含有分子数为NA | |
| D. | 46g NO2和N2O4混合气体含有的原子数为3NA |
分析 A、氯化钠为离子晶体;
B、合成氨的反应为可逆反应;
C、标况下三氯甲烷为液态;
D、NO2和N2O4的最简式均为NO2.
解答 解:A、氯化钠为离子晶体,无氯化钠分子,故A错误;
B、合成氨的反应为可逆反,不能进行彻底,故转移的电子数小于6NA个,故B错误;
C、标况下三氯甲烷为液态,故不能根据气体摩尔体积来计算其物质的量,故C错误;
D、NO2和N2O4的最简式均为NO2,故46g混合物中含有的NO2的物质的量为1mol,故含有3NA个原子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
18.在一定条件下,发生反应:2X(g)+Y(g)?Z(g)△H=-197kJ•mol-1,若将2mol X和1mol Y充入2L的恒容密闭容器中,反应10min,测得X的物质的量为1.4mol,下列说法正确的是( )
| A. | 10min内,反应放出的热量为197kJ热量 | |
| B. | 10min内,X的平均反应速率为0.06mol•L-1•min-1 | |
| C. | 第10min时,Y的反应速率小于0.015mol•L-1•min-1(假如体系温度不变) | |
| D. | 第10min时,Z浓度为0.6mol•L-1 |
19.下列各项实验操作中正确的是( )
| A. | 用酒精萃取溴水中溴单质的操作可选用分液漏斗,而后静置分液 | |
| B. | 溶解固体时烧杯在使用前必须干燥 | |
| C. | 萃取、分液前需对分液漏斗检漏,分液操作时,分液漏斗中下层液体及上层液体均从下口放出 | |
| D. | 蒸馏操作时,不可以用温度计搅拌,温度计水银球靠近蒸馏烧瓶的支管口处 |
16.NA表示阿伏伽德罗常数,下列说法正确的是( )
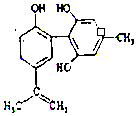

| A. | 标准状况下,22.4L HF中含有氟原子数目为NA | |
| B. | 0.1mol/L的NH4HSO4溶液中滴加0.1mol/L的Ba(OH)2溶液至沉淀刚好完全:c(NH4+)>c(OH-)>c(SO42-)>c(H+) | |
| C. | 1mol 如图物质与浓溴水反应时通常最多消耗Br2为6mol | |
| D. | 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA |
3.阿伏加德罗常数约为6.02×1023 mol-1,下列说法正确的是( )
| A. | 2.3 g钠与足量丙三醇反应,转移电子数为0.3×6.02×1023 | |
| B. | 标准状况下,22.4 L乙醇的共价键数为8×6.02×1023 | |
| C. | 标准状况下,5.6 L甲醛所含的电子数为4×6.02×1023 | |
| D. | 100 mL 1 mol•L-1醋酸溶液中,H+的个数为0.1×6.02×1023 |
13.能正确表示下列反应的离子方程式是( )
| A. | 钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| B. | 碳酸钠溶液中加入澄清石灰水:Ca(OH)2+CO32-=CaCO3↓+2OH- | |
| C. | 氢氧化钠溶液中通入过量CO2:OH-+CO2=HCO3- | |
| D. | FeCl3溶液与Cu反应:Cu+Fe3+=Cu2++Fe2+ |
4.下列关于判断过程的方向的说法正确的是( )
| A. | 常温时不能发生的过程都是非自发过程 | |
| B. | 体系的无序性越高,即混乱度越高,熵值就越大 | |
| C. | 所有自发进行的化学反应都是放热反应 | |
| D. | 同一物质的固、液、气三种状态的熵值相同 |
 .②中离子方程式为Br-+Ag+═AgBr↓.
.②中离子方程式为Br-+Ag+═AgBr↓. 与Br2,要想得到纯净的产物,可用NaOH溶液试剂洗涤.洗涤后分离粗产品应使用的仪器是分液漏斗.
与Br2,要想得到纯净的产物,可用NaOH溶液试剂洗涤.洗涤后分离粗产品应使用的仪器是分液漏斗.