题目内容
7.下列反应在210℃时达到平衡:①PCl5(g)?PCl3(g)+Cl2(g)+Q Q<0 K1=1
②CO(g)+Cl2(g)?COCl2(g)+Q Q>O K2=5×104
③COCl2(g)?CO(g)+Cl2(g)+Q K3=?
(1)氯原子核外有5种不同能级的电子,最外层上的电子云有4种不同的伸展方向
(2)上述反应中有多种元素,请按照原子半径由大到小进行排序:P>Cl>C>O.
(3)碳与其同主族的短周期元素相比较,二者的最高价氧化物的熔沸点差异较大,原因是二氧化碳晶体是分子晶体,二氧化硅是原子晶体,所以后者熔沸点远高于前者.
(4)下列不可用于比较氧和碳非金属性强弱的是bc
a、单质与氢气化合的难易 b、最高价含氧酸的酸性
c、水的沸点高于甲烷 d、二者形成的化合物中元素的化合价
(5)210℃时,K3=5×104(填计算结果).210℃时,向一个容积3L的恒温恒容的密闭容器中加入6molPCl5(g),达到平衡后,PCl5(g)的平衡转化率为50%;若达到平衡所需的时间为a分钟,则从反应开始至达到平衡的过程中,C12(g)的平均反应速率为$\frac{1}{a}$mol/(L•min.
(6)若向一个绝热恒容的密闭容器中加入1molC12(g)和1molCO(g),达到平衡后,再加入C12(g),则平衡②将向右移动(填“向左”、“向右”、或者“不”),K2将会减小(填“增大”、“减小”或“不变”).
分析 (1)Cl原子核外电子排布为1s22s22p63s23p5,能层和能级决定电子的能量,电子云不同的伸展方向即为轨道数;
(2)电子层越多半径越大,同周期元素的原子,从左到右原子半径逐渐减小,核外电子排布相同的离子,核电荷数越多半径越小;
(3)根据CO2与SiO2形成的晶体类型进行解答,CO2是分子晶体,SiO2是原子晶体,原子晶体的熔点高于分子晶体;
(4)比较两种元素的非金属性强弱,可根据单质之间的置换反应、与氢气反应的难易程度、氢化物的稳定性以及最高正价氧化物对应水化物酸性强弱;
(5)平衡常数等于生成物浓度的化学计量数幂之积除以反应物的浓度的化学计量数幂之积,由于反应③=①+②,故K3=K1×K2,据此计算;
(6)根据反应CO(g)+Cl2(g)?COCl2(g)+Q Q>O,可知增加反应物的浓度,平衡正向移动,反应放热,在绝热条件,容器内温度升高,平衡向吸热方向移动,且平衡常数发生改变.
解答 解:(1)Cl原子核外电子排布为1s22s22p63s23p5,有5种不同能级的电子,最外层上的电子云有4种不同的伸展方向,
故答案为:5;4;
(2)P、Cl有三个电子层,C、O有二个电子层,故P、Cl的半径大于C、O.Cl核电荷数越多于P,故P半径大于Cl.O核电荷数越多于C,故C半径大于O.即P>Cl>C>O,
故答案为:P>Cl>C>O;
(3)CO2是分子晶体,CO2的熔化与C=O键能没有关系,其熔化只需要克服范德华力(分子间作用力),SiO2是原子晶体,其熔化要破坏Si-O共价键,共价键的强度远远大于范德华力,
故答案为:二氧化碳晶体是分子晶体,二氧化硅是原子晶体,所以后者熔沸点远高于前者;
(4)a、单质与氢气化合的难易可用于比较氧的非金属性比碳的非金属性强,故不选a;
b、最高价含氧酸的酸性不可用于比较氧和碳非金属性强弱,因氧无含氧酸,故选b;
c、水的沸点高于甲烷,不可用于比较氧和碳非金属性强弱,因沸点是物质的物理性质,与化学性质--非金属性强弱无关,故选c;
d、二者形成的化合物中元素的化合价可用于比较氧的非金属性比碳的非金属性强,因CO2中碳显+4价,氧显-2价,故不选d.
故答案为:bc;
(5)平衡常数等于生成物浓度的化学计量数幂之积除以反应物的浓度的化学计量数幂之积,由于反应③=①+②,故K3=K1×K2=1×5×104=5×104,
PCl5(g)?PCl3(g)+Cl2(g)
起始浓度(mol/L) 2 0 0
变化浓度(mol/L) x x x
平衡浓度(mol/L) 2-x x x
则:$\frac{{x}^{2}}{2-x}$=1,解得x=1,PCl5(g)的平衡转化率为$\frac{1mol/L}{2mol/L}$×100%=50%;
C12(g)的平均反应速率为$\frac{1mol/L}{amin}$=$\frac{1}{a}$mol/(L•min);
故答案为:5×104;50%;$\frac{1}{a}$mol/(L•min;
(6)增大反应物的浓度,促进平衡正向移动,即反应向右进行,同时放出大量的热,在绝热容器中,温度升高,平衡逆向移动,平衡常数K2减小,
故答案为:向右;减小.
点评 本题综合性较强,考查了原子的核外电子排布规律、原子半径的比较、晶体结构分析及平衡常数的计算与影响因素,难度较大,对培养学生运用知识综合分析问题、解决问题的能力提高有很大作用.

| A. | HCl、HBr、HI的热稳定性依次增强 | B. | KOH的碱性比NaOH的碱性强 | ||
| C. | HBrO4酸性比HClO4强 | D. | Na的金属性比Al的弱 |
 铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:
铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:(1)已知高炉炼铁过程中会发生如下反应:
FeO(s)+CO(g)═Fe(s)+CO2(g)△H1
Fe2O3(s)+$\frac{1}{3}$CO(g)═$\frac{2}{3}$Fe3O4(s)+$\frac{1}{3}$CO2(g)△H2
Fe3O4(s)+CO(g)═3Fe(s)+CO2(g)H3
Fe2O3(s)+CO(g)═2Fe(s)+3CO2(g)H4
则△H4的表达式为△H2+$\frac{2}{3}$△H3(用含△H1、△H2、△H3的代数式表示).
(2)上述反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如下:
| 温度 | 250℃ | 600℃ | 1000℃ | 2000℃ |
| 主要成分 | Fe2O3 | Fe3O4 | FeO | Fe |
(3)铁等金属可用作CO与氢气反应的催化剂.已知某种催化剂可用来催化反应 CO(g)+3H2(g)?CH4(g)+H2O(g)△H<0.在T℃,106Pa时将l mol CO和3mol H2加入体积可变的密闭容器中.实验测得CO的体积分数x(CO)如下表:
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| x(CO) | 0.25 | 0.23 | 0.214 | 0.202 | 0.193 | 0.193 |
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v正(CO)=3v逆(H2) d.混合气体的平均相对分子质量不再发生变化
②达到平衡时CO的转化率为37.1%;在T℃106Pa时该反应的压强平衡常数Kp(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)的计算式为$\frac{(\frac{0,371}{3.258})^{2}}{0.193×(\frac{1.887}{3.258})^{3}×1{0}^{12}P{a}^{2}}$;
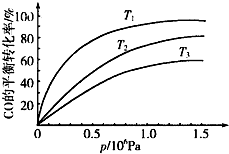
③图表示该反应CO的平衡转化率与温度、压强的关系.图中温度T1、T2、T3由高到低的顺序是T3>T2>T1,理由是正反应放热,在相同压强下,温度降低,平衡向正反应方向移动,CO的转化率越高.
| A. | 新的平衡体系中,N2的浓度小于2c mol/L大于c mol/L | |
| B. | 新的平衡体系中,NH3的浓度小于2c mol/L大于c mol/L | |
| C. | 新的平衡体系中,混合气体的平均摩尔质量小于$\overline{M}$ | |
| D. | 新的平衡体系中,气体的密度是原平衡体系的1倍 |
 三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如图所示,已知其燃烧时P被氧化为P4010,下列有关P4S3的说法中不正确的是( )
三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如图所示,已知其燃烧时P被氧化为P4010,下列有关P4S3的说法中不正确的是( )| A. | P4S3中磷元素为+3价 | |
| B. | P4S3属于共价化合物 | |
| C. | P4S3充分燃烧的化学方程式为P4S3+8O2=P4O10+3SO2 | |
| D. | 1 mol P4S3分子中含有9 mol共价键 |