题目内容
10.根据元素周期表和周期律,下列推断正确的是( )| A. | HCl、HBr、HI的热稳定性依次增强 | B. | KOH的碱性比NaOH的碱性强 | ||
| C. | HBrO4酸性比HClO4强 | D. | Na的金属性比Al的弱 |
分析 A.非金属越强,对应氢化物越稳定;
B.金属性越强,对应碱的碱性越强;
C.非金属性越强,对应最高价含氧酸的酸性越强;
D.同周期从左向右金属性减弱.
解答 解:A.非金属Cl>Br>I,HCl、HBr、HI的热稳定性依次减弱,故A错误;
B.金属性K>Na,KOH的碱性比NaOH的碱性强,故B正确;
C.非金属性Cl>Br,HBrO4酸性比HClO4弱,故C错误;
D.同周期从左向右金属性减弱,则Na的金属性比Al的强,故D错误;
故选B.
点评 本题考查元素周期表和周期律,为高频考点,把握元素性质、元素的位置、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
20.如表是元素周期表的一部分,回答下列有关问题:
(1)写出下列元素符号:①N,⑥Si.
(2)画出原子的结构示意图:④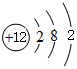 ,⑤
,⑤ .
.
(3)在这些元素中,最活泼的金属元素是K,最活泼的非金属元素是F,最不活泼的元素是Ar.(均用元素符号表示)
(4)在这些元素的最高价氧化物对应水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.(均写出物质的化学式)
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)画出原子的结构示意图:④
 ,⑤
,⑤ .
.(3)在这些元素中,最活泼的金属元素是K,最活泼的非金属元素是F,最不活泼的元素是Ar.(均用元素符号表示)
(4)在这些元素的最高价氧化物对应水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.(均写出物质的化学式)
15.设NA为阿伏伽德罗常数的值.下列有关叙述正确的是( )
| A. | 1molFe溶于过量硝酸,电子转移数为2NA | |
| B. | 1mol O2和2mol SO2反应生成的SO3分子数为2NA | |
| C. | 常温常压下,4.4gCO2与N2O混合气体中含有的原子数为0.3NA | |
| D. | H2O2分解产生1molO2,转移的电子数为4NA |
8.K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+.用K2Cr2O7溶液进行下列实验:

结合实验,下列说法正确的是( )

结合实验,下列说法正确的是( )
| A. | ①中溶液变黄,③中溶液橙色加深 | |
| B. | ②中Cr2O72-被C2H5OH氧化 | |
| C. | 对比②和④可知K2Cr2O7酸性溶液氧化性强 | |
| D. | 若向④中加入70%H2SO4溶液至过量,溶液变为橙色 |
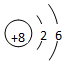 、
、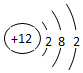
 .
.