题目内容
19.在已经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种,但与生产生活有密切的联系.(1)为了提高煤的利用率,常将其气化为可燃性气体,主要反应是碳和水蒸气反应生成水煤气,化学反应方程式为C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g).
(2)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:
N2(g)+3H2(g)$?_{催化剂}^{高温高压}$2NH3(g).
①合成氨的反应中的能量变化如图1所示.
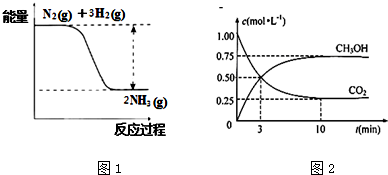
该反应是放热反应(填“吸热”或“放热”),其原因是反应物化学键断裂吸收的总能量小于(填“大于”或“小于”)生成物化学键形成放出的总能量.
②在一定条件下,将一定量的N2和H2的混合气体充入某定容密闭容器中,一段时间后,下列叙述不能说明该反应达到平衡状态的是AC(填序号).
A.容器中混合气体的密度不随时间变化
B.单位时间内断裂3mol H-H键的同时断裂6mol N-H键
C. N2、H2、NH3的物质的量之比为1:3:2
D.容器中混合气体的平均相对分子质量不随时间变化
(3)目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),在体积为1L的密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示.
①从反应开始到平衡,用氢气浓度变化表示的平均反应速率v (H2)=0.225mol/(L.min).
②达平衡时容器内平衡时与起始时的压强之比5:8(或0.625).
分析 (1)C与水反应生成CO和氢气;
(2)①由图可知,反应物的总能量大于生成物的总能量;断裂化学键吸收能量,生成化学键释放能量;
②结合平衡时正逆反应速率相等、各组分的浓度不变等及其衍生的一些物理量分析;
(3)由图2可知,甲醇的浓度变化量为0.75mol/L,根据v=$\frac{△c}{△t}$计算v(CH3OH),再利用速率之比等于化学计量数之比计算v(H2),相同条件下气体压强之比等于气体物质的量之比.
解答 解:(1)C与水反应生成CO和氢气,反应为C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO (g)+H2(g),
故答案为:C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO (g)+H2(g);
(2)①由图可知,反应物的总能量大于生成物的总能量,则该反应为放热反应,断裂化学键吸收能量,生成化学键释放能量,△H=断裂化学键吸收能量-生成化学键释放能量<0,可知断裂化学键吸收能量小于生成化学键释放能量,
故答案为:放热;小于;
②A.由于气体的质量以及容器的体积不变,则容器中混合气体的密度不随时间变化,不能用于判断是否达到平衡,故A错误;
B.单位时间内断裂3mol H-H键的同时断裂6mol N-H键,说明正逆反应速率相等,达到平衡状态,故B正确;
C. 因不能确定起始配比数、转化率以及平衡常数,则N2、H2、NH3的物质的量之比为1:3:2不能说明达到平衡状态,故C错误;
D.容器中混合气体的平均相对分子质量不随时间变化,说明气体的物质的量不变,达到平衡状态,故D正确.
故答案为:AC;
(3)①由图2可知,10min达平衡时甲醇的浓度变化量为0.75mol/L,所以v(CH3OH)=$\frac{0.75mol/L}{10min}$=0.075mol/(L•min),速率之比等于化学计量数之比,所以v(H2)=3v(CH3OH)=3×0.075mol/(L•min)=0.225mol/(L•min),
故答案为:0.225mol/(L.min);
②反应前后气体压强之比等于其物质的量之比,反应前气体物质的量=4mol,甲醇生成0.75mol,最后达到平衡状态二氧化碳物质的量0.25mol,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
起始量(mol) 1 3 0 0
变化量(mol) 0.75 2.25 0.75 0.75
平衡量(mol) 0.25 0.75 0.75 0.75
达平衡时容器内平衡时与起始时的压强之比=(0.25+0.75+0.75+0.75):(1+3)=5:8=0.625,
故答案为:5:8 (或0.625).
点评 本题考查较为综合,为高考常见题型,侧重于学生的分析、计算能力,化学图象分析、化学平衡状态的判断、化学平衡状态的判定等,注重高频考点的考查,有利于基础知识和基本能力的培养,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案现在隔一定时间对该容器内的物质进行分析,得到如下表格:
| t/s c/(mol•L-1) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)/(mol•L-1) | 0.100 | c1 | 0.050 | c3 | a | b |
| c(NO2)/(mol•L-1) | 0 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
(1)达到平衡时N2O4的转化率为60%,表中c2>c3,a=b(后两空选填>、<、=)
(2)20s的N2O4的浓度c1=0.07mol/L在0~20s内N2O4的平均反应速率为0.0015mol/(L•s);
(3)若其他反应条件以及初始物质物质的量不变,将反应的温度降低到80℃时,达到平衡时NO2的物质的量为0.100mol,那么正反应是吸热反应(选填吸热或放热)
(4)若在相同初始情况下最初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度为0.20mol/L.
| A. | 实验室中酒精灯着火,立即用水扑灭 | |
| B. | 实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室 | |
| C. | 皮肤上不慎沾上NaOH溶液,立即用盐酸冲洗 | |
| D. | 稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断搅拌 |

结合实验,下列说法正确的是( )
| A. | ①中溶液变黄,③中溶液橙色加深 | |
| B. | ②中Cr2O72-被C2H5OH氧化 | |
| C. | 对比②和④可知K2Cr2O7酸性溶液氧化性强 | |
| D. | 若向④中加入70%H2SO4溶液至过量,溶液变为橙色 |
| A. | 100℃时,某溶液pH=6,则该溶液一定显酸性 | |
| B. | 25℃时,0.1mol/L的NaHSO3溶液pH=4,溶液中c(SO32-)<c(H2SO3) | |
| C. | 25℃时,pH=3的硫酸溶液与pH=11的氨水等体积混合,所得溶液呈酸性 | |
| D. | 室温下,10mL0.1mol/L CH3COOH溶液与5mLO.lmol/LNaOH溶液混合,所得溶液中有:2c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-) |
 、
、