题目内容
2.用太阳能电解水可获得最理想的单质燃料X,但运输极不方便,国外试用了如下的方法把X转变成便于运输的甲醇燃料;将空气通过极浓的NaOH溶液中,此时空气中的Y有70%被吸收,转变为正盐Z,当Z达到饱和后即加入硫酸,此时溶液会放出纯净的气体Y.一定条件下通过X与Y反应生成甲醇.试回答以下问题:(1)Z是Na2CO3(写化学式),X和Y反应的化学方程式为CO2+3H2?CH3OH+H2O.
(2)温度仍为120℃,活塞可左右自由滑动并且导热,

起始时Ⅰ中X为n mol,Y为6.5 mol,CH3OH(g)和D各为2 mol;Ⅱ中A、B、C各为4 mol.当 n 在一定范围内变化时,均可通过调节反应器的温度(Ⅰ和Ⅱ中温度始终相等),使两侧反应都达到平衡,并且隔板恰好处于反应器的正中位置.
回答下列问题:
①若 n=2.5,则1中起始时反应向正反应(填“正反应”或“逆反应”)方向进行.欲使起始时反应向该方向进行,则 n 的取值范围是1.5<n<4.5.
②若 n 分别取3.0和4.0,则在这两种情况下,当反应分别达到平衡时,A的物质的量不相等(填“相等”或“不相等”),理由是温度不同.
分析 (1)水分解得到的可燃气体为氢气,则X为氢气;空气中能被NaOH吸收的气体为CO2,则Y为CO2、Z为Na2CO3;CO2与氢气反应生成甲醇;
(2)①n=2.5时,I中气体初始物质的量为:2.5 mol+6.5 mol+2 mol+2 mol=13 mol,Ⅱ中气体的物质的量始终为12 mol,如要是隔板停留在中间,左侧反应应向正反应方向移动,以使气体体积得到12 mol;
要使反应向正方向进行,左侧气体的初始物质的量应大于12 mol,则n mol+10.5 mol>12 mol,同时还要满足,当CO2或H2完全转化为产物时,气体总物质的量应小于12 mol,若CO2完全转化,生成CH3OH和H2O物质的量均为6.5 mol,已经大于12 mol,故应为氢气完全转化时,气体总物质的量小于12 mol,则6.5 mol-$\frac{1}{3}$n mol+4 mol+$\frac{2}{3}$n mol<12 mol,据此进行计算;
②当n取值3.0和4.0时,反应达平衡时总物质的量不变,反应的转化率不同,结合反应温度不同判断平衡时A的物质的量.
解答 解:(1)水分解得到的可燃气体为H2,则X为氢气;空气中能被NaOH吸收的气体为CO2,则Y为CO2、Z为Na2CO3,CO2与氢气反应生成甲醇的反应为:CO2+3H2O=CH3OH+H2O,
故答案为:Na2CO3;CO2+3H2?CH3OH+H2O;
(2)①n=2.5时,I中气体初始物质的量为:2.5 mol+6.5 mol+2 mol+2 mol=13 mol,Ⅱ中气体的物质的量始终为12 mol,如要是隔板停留在中间,左侧反应应向正反应方向移动,以使气体体积得到12 mol;
要使反应向正方向进行,左侧气体的初始物质的量应大于12 mol,故:n mol+10.5 mol>12 mol,即n>1.5,同时还要满足,当CO2或H2完全转化为产物时,气体总物质的量应小于12 mol,若CO2完全转化,生成CH3OH和H2O物质的量均为6.5 mol,已经大于12 mol,故应为氢气完全转化时,气体总物质的量小于12 mol,则有:6.5 mol-$\frac{1}{3}$n mol+4 mol+$\frac{2}{3}$n mol<12 mol,n<4.5,所以n的取值范围为:1.5<n<4.5,
故答案为:正反应;1.5<n<4.5;
②当n取值3.0和4.0时,反应达平衡时总物质的量均为12 mol时,反应的转化率不同,反应温度不同,故平衡时A的物质的量不同,
故答案为:不相等;温度不同.
点评 本题考查了化学平衡的移动、物质的推断以及有关基本计算,题目难度中等,明确化学平衡及其影响为解答关键,注意掌握讨论法在化学计算中的应用,试题培养了学生的分析、理解能力及化学计算能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 分液时,分液漏斗的上层液体应由上口到出 | |
| B. | 向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液一定是碳酸盐溶液 | |
| C. | 配置0.1000mol•L-1氢氧化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流 | |
| D. | 锥形瓶用作反应容器时可以加热 |
| A. | 实验室中酒精灯着火,立即用水扑灭 | |
| B. | 实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室 | |
| C. | 皮肤上不慎沾上NaOH溶液,立即用盐酸冲洗 | |
| D. | 稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断搅拌 |
| A. | 向沸腾的蒸馏水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+ | |
| B. | 向碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | 向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 稀硝酸和过量的铁屑反应:Fe+4H++NO3-═Fe3++NO↑+2H2O |
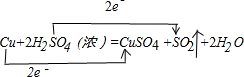 .
.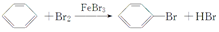 ,
,