题目内容
18.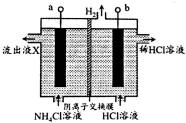 NCl3是一种黄色粘稠的油状液体(已知电负性:N>Cl)装置如图所示,利用惰性电极电解制备,原理是:NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$NCl3+3H2↑,下列说法错误的是( )
NCl3是一种黄色粘稠的油状液体(已知电负性:N>Cl)装置如图所示,利用惰性电极电解制备,原理是:NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$NCl3+3H2↑,下列说法错误的是( )| A. | b电极接电源的负极 | |
| B. | 阳极区被氧化的元素为Cl | |
| C. | 流出液X中不含HCl | |
| D. | 每生成3molH2,有6molCl-通过阴离子交换膜 |
分析 根据图示信息知道:a电极是阳极,该电极上发生失电子的氧化反应NH4++3Cl--6e-=NCl3+4H+,b电极是阴极,在阴极上是氢离子得电子的还原反应,电极反应式为:2H++2e-=H2↑,电解过程中,阴离子可以经过阴离子交换膜移向阳极,但是阳离子不能经过交换膜,根据电子守恒以及电极反应式进行计算回答.
解答 解:根据图示信息知道:a电极是阳极,该电极上发生失电子的氧化反应NH4++3Cl--6e-=NCl3+4H+,b电极是阴极,在阴极上是氢离子得电子的还原反应,电极反应式为:2H++2e-=H2↑,电解过程中,阴离子可以经过阴离子交换膜移向阳极,但是阳离子不能经过交换膜,根据电子守恒以及电极反应式进行计算回答.
A.b电极产生氢气,发生的是还原反应,b电极是阴极,故接电源的负极,故A正确;
B.题干由已知电负性:N>Cl,故NCl3中Cl为+1价,Cl元素化合价升高被氧化,故B正确;
C.电解过程中,Cl-可以经过阴离子交换膜移向阳极,阳极发生氧化反应NH4++3Cl--6e-=NCl3+4H+,流出液X中含HCl,故C错误;
D.每生成3molH2,转移6mol电子,溶液中通过离子定向移动形成闭合回路平衡电荷,故有6molCl-通过阴离子交换膜,故D正确.
故选C.
点评 本题考查学生电解池的工作原理以及应用知识,注意电极反应式的书写和电子守恒的计算是解题的关键,难度中等.

练习册系列答案
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案
相关题目
12.研究证明,CO2可作为合成低碳烯烃的原料加以利用,目前利用CO2合成乙烯相关的热化学方程式如下:
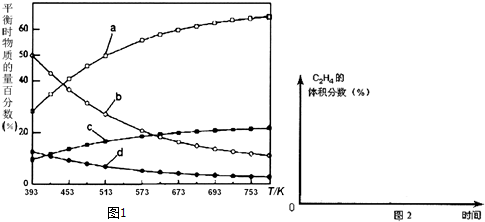
反应开始时在0.l MPa下,以n(H2):n(CO2)=3:1的投料比充入体积固定的密闭容器中,发生反应Ⅳ,不同温度下平衡时的四种气态物质的物质的量百分数如图1所示,请回答下列问题:
(1)△H4=-128 kJ/mol.
(2)可判断该反应体系已平衡的是CE.
A.v (CO2)=2v (C2H4)
B.混合气体的密度不再改变
C.混合气体的压强不再改变
D.平衡常数K不再改变
E.C2H4的体积分数不变
(3)曲线a表示的物质为H2(写化学式),判断依据是由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,反应开始时在0.1MPa下,n(H2):n(CO2)=3:1的投料比可知a为H2的变化曲线,c为CO2的变化曲线,结合计量数关系可知b为水,d为C2H4的变化曲线.
(4)为提高CO2的平衡转化率,可以采取的措施是ABD.
A.降低温度
B.分离出H2O
C.增加原催化剂的表面积
D.增大压强
E.投料比改为n(H2):n(CO2)=2:1
(5)在图2中,画出393K时体系中C2H4的体积分数随反应时间(从常温进料开始计时)的变化趋势曲线,并标明平衡时C2H4的体积分数数值.
| 反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) | △H1=-49.01kJ•mol-1 |
| 反应Ⅱ:2CH3OH(g)?CH3OCH3(g)+H2O(g) | △H2=-24.52kJ•mol-1 |
| 反应Ⅲ:CH3OCH3(g)?C2H4(g)+H2O(g) | △H3=-5.46kJ•mol-1 |
| 反应Ⅳ:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g) | △H4 |

(1)△H4=-128 kJ/mol.
(2)可判断该反应体系已平衡的是CE.
A.v (CO2)=2v (C2H4)
B.混合气体的密度不再改变
C.混合气体的压强不再改变
D.平衡常数K不再改变
E.C2H4的体积分数不变
(3)曲线a表示的物质为H2(写化学式),判断依据是由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,反应开始时在0.1MPa下,n(H2):n(CO2)=3:1的投料比可知a为H2的变化曲线,c为CO2的变化曲线,结合计量数关系可知b为水,d为C2H4的变化曲线.
(4)为提高CO2的平衡转化率,可以采取的措施是ABD.
A.降低温度
B.分离出H2O
C.增加原催化剂的表面积
D.增大压强
E.投料比改为n(H2):n(CO2)=2:1
(5)在图2中,画出393K时体系中C2H4的体积分数随反应时间(从常温进料开始计时)的变化趋势曲线,并标明平衡时C2H4的体积分数数值.
6.下列实验装置能达到相应实验目的是( )
| A. |  用图装置制取Fe(OH)2沉淀 | B. |  用图装置吸收NH3并防止倒吸 | ||
| C. |  用图装置制取少量氧气 | D. |  用图装置除去CO2中含有的少量HCl |
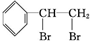
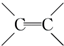
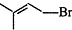
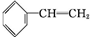 +Br2
+Br2
 .
. $\stackrel{稀,冷KMnO_{4},溶液/OH-}{→}$
$\stackrel{稀,冷KMnO_{4},溶液/OH-}{→}$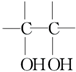 .请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式
.请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式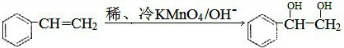 .
. .
.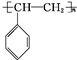 .
.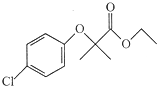 )是临床一种应用广泛的药物,它的一条合成路线如下:
)是临床一种应用广泛的药物,它的一条合成路线如下: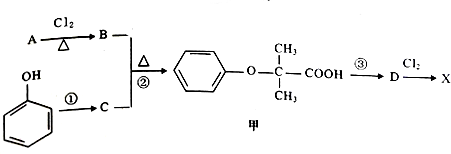
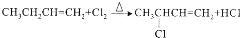
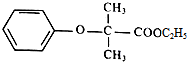 .
. 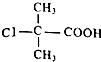 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$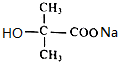 +NaCl+H2O.
+NaCl+H2O. 
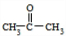 .
.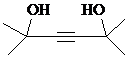 .
.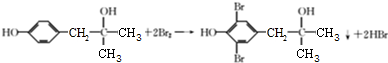 .
.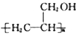 的合成路线图(无机试剂任用).合成路线图示例如下:
的合成路线图(无机试剂任用).合成路线图示例如下: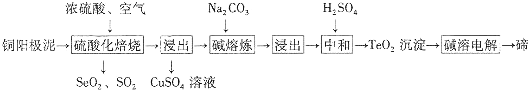
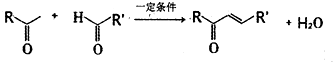
 生成高分子化合物的方程式
生成高分子化合物的方程式 .
. 、
、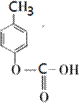 .
.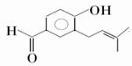 .
.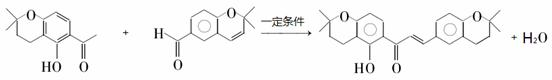 .
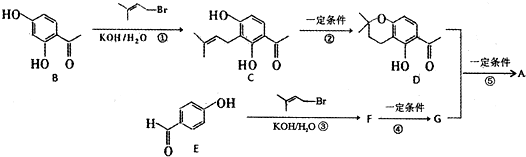
. $→_{①}^{Cl_{2},光照}$
$→_{①}^{Cl_{2},光照}$ $→_{△②}^{NaOH醇溶液}$A$→_{③}^{Cl_{2},不见光}$B$\stackrel{④}{→}$
$→_{△②}^{NaOH醇溶液}$A$→_{③}^{Cl_{2},不见光}$B$\stackrel{④}{→}$ $\stackrel{⑤}{→}$
$\stackrel{⑤}{→}$ $\stackrel{⑥}{→}$$→_{H_{2}}^{⑦}$
$\stackrel{⑥}{→}$$→_{H_{2}}^{⑦}$
 ,C
,C
 .
.