题目内容
10.硒和碲有许多用途、在工业上以铜阳极泥(含有Cu、Se、Cu2S、Cu2Se、Cu2Te、CuSe、CuTe等)为原料制备硒和碲的工艺流程如图所示: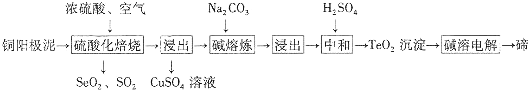
已知:SeO2315℃eO2是两性氧化物,难溶于水.
(1)“硫酸化焙烧”中Se与浓硫酸发生反应,写出反应的化学反应方程式Se+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$SeO2↑+2SO2↑+2H2O.SeO2与SO2的混合烟气可用水吸收制得单质Se,写出反应的化学反应方程式SeO2+2H2O+2SO2=Se+2H2SO4.
(2)“中和”时控制溶液PH在4.5~5.0之间以生成TeO2沉淀硫酸过量时,碲产率降低的原因是TeO2与硫酸反应,沉淀量减小.
(3)碲的获得通过电解Na2TeO3溶液实现,其阴极电极反应式是TeO32-+3H2O+4e-=Te+6OH-.
(4)铜阳极泥中硒含量的测定通常采用碘量法,其原理是SeO2在酸性条件下被I-还原为单体硒,并析出游离碘;然后用硫代硫酸钠标准溶液滴定,反应式为:I2+2Na2S2O3═2NaI+Na2S4O6.取阳极泥0.50g,指示剂显示终点时共用去0.1mol•L-1硫代硫酸钠溶液20.00mL.在此过程中:
①SeO2与碘化钾反应的离子方程式为SeO2+4I-+4H+=Se+2I2+2H2O.
②滴定操作中指示剂通常为淀粉溶液,滴定至终点的现象是溶液由蓝色突变为无色,且半分钟内不恢复原色.
③测得铜阳极泥中硒的含量为7.9%.
分析 以铜阳极泥(主要成分为Cu、Se、Cu2S、Cu2Se、Cu2Te、CuSe、CuTe等)加入硫酸焙烧,得到SeO2、SO2和TeO2等,浓硫酸起氧化剂作用,由元素守恒可知还生成CuSO4与水,滤渣再进行水浸,浸出液中含有CuSO4,SeO2是两性氧化物,难溶于水,浸渣中含有SeO2,+4价Se的氧化性强于+4价S的氧化性,SeO2、SO2混合气体用水吸收得到H2SO4、Se,过滤分离,滤液中含有硫酸,经过净化除杂得到Se.硫酸焙烧后的浸出液为CuSO4溶液,TeO2中加入碳酸钠进行熔炼,浸出得到Na2TeO3溶液,加硫酸中和多余的碱,得到TeO2沉淀,加碱得到Na2TeO3溶液,电解得到Te.
(1)硒和浓硫酸发生反应生成二氧化硒、二氧化硫、水,SeO2、SO2混合气体用水吸收得到H2SO4、Se,据此书写相关的反应方程式;
(2)过量的硫酸能和TeO2反应,碲产率降低;
(3)电解池的阴极发生还原反应,据此书写电极反应式;
(4)①+4价Se具有氧化性,SeO2与碘化钾反应,碘离子被氧化成单质碘,自身被还原成单质硒;
②碘单质与淀粉作用显示蓝色,据此判断滴定终点的现象;
③根据关系式SeO2~2I2~4Na2S2O3计算n(Se),再根据m=nM计算m(Se)以此计算铜阳极泥中硒的含量.
解答 解:以铜阳极泥(主要成分为Cu、Se、Cu2S、Cu2Se、Cu2Te、CuSe、CuTe等)加入硫酸焙烧,得到SeO2、SO2和TeO2等,浓硫酸起氧化剂作用,由元素守恒可知还生成CuSO4与水,滤渣再进行水浸,浸出液中含有CuSO4,SeO2是两性氧化物,难溶于水,浸渣中含有SeO2,+4价Se的氧化性强于+4价S的氧化性,SeO2、SO2混合气体用水吸收得到H2SO4、Se,过滤分离,滤液中含有硫酸,经过净化除杂得到Se.硫酸焙烧后的浸出液为CuSO4溶液,TeO2中加入碳酸钠进行熔炼,浸出得到Na2TeO3溶液,加硫酸中和多余的碱,得到TeO2沉淀,加碱得到Na2TeO3溶液,电解得到Te.
(1)硒和浓硫酸发生反应,硒被浓硫酸氧化成+4价的硒,自身被还原成+4价的硫,生成二氧化硒、二氧化硫、水,反应方程式为:Se+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$SeO2↑+2SO2↑+2H2O,+4价Se的氧化性强于+4价S的氧化性,SeO2、SO2混合气体用水吸收得到H2SO4、Se,反应方程式为:SeO2+2H2O+2SO2=Se+2H2SO4,
故答案为:Se+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$SeO2↑+2SO2↑+2H2O;SeO2+2H2O+2SO2=Se+2H2SO4;
(2)过量的硫酸能和TeO2反应,2TeO2+2H2SO4(浓)=2TeO2•SO3+2H2O,沉淀量减小,碲产率降低,
故答案为:TeO2与硫酸反应,沉淀量减小;
(3)电解Na2TeO3溶液,阴极TeO32-得到电子,电极反应为:TeO32-+3H2O+4e-=Te+6OH-,
故答案为:TeO32-+3H2O+4e-=Te+6OH-;
(4)①SeO2在酸性条件下被I-还原为单体硒,SeO2与碘化钾反应,碘离子被氧化成单质碘,反应方程式为:SeO2+4I-+4H+=Se+2I2+2H2O,
故答案为:SeO2+4I-+4H+=Se+2I2+2H2O;
②铜阳极泥中硒含量的测定通常采用碘量法,SeO2在酸性条件下被I-还原为单体硒,并析出游离碘,用硫代硫酸钠标准溶液滴定,反应式为:I2+2Na2S2O3═2NaI+Na2S4O6,碘单质与淀粉作用显示蓝色,滴定至终点的现象是溶液由蓝色突变为无色,且半分钟内不恢复原色,
故答案为:淀粉溶液;溶液由蓝色突变为无色,且半分钟内不恢复原色;
③SeO2在酸性条件下被I-还原为单体硒,SeO2+4I-+4H+=Se+2I2+2H2O,I2+2Na2S2O3═2NaI+Na2S4O6.可得关系式:SeO2~2I2~4Na2S2O3,n(Se)=$\frac{1}{4}$×0.1mol•L-1×20.00mL=5×10-4mol,m(Se)=nM=5×10-4mol×79g/mol=79×5×10-4g,铜阳极泥中硒的含量为$\frac{79×5×1{0}^{-4}}{0.5}$×100%=7.9%,
故答案为:7.9%.
点评 本题考查实验制备方案、氧化还原反应滴定计算、物质的分离提纯、对条件与操作的分析评价,是对学生综合能力的考查,注意题目信息的迁移运用,明确制备流程、发生反应原理为解答关键,题目难度中等.

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案| A. | 标准状况下,46 g乙醇中含有的共价键总数为8 NA | |
| B. | 在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA | |
| C. | 常温常压下,7.8 gNa2S和Na2O2的混合物中,阴离子所含电子数为1.8 NA | |
| D. | 一定条件下,2molSO2和1molO2混合在密闭容器中充分反应后容器中的分子数大于2NA |

| A. | 可利用淀粉水解产生的X试剂与溶液1反应制金属1 | |
| B. | Y试剂可通过氯碱工业制得 | |
| C. | 过量Z与溶液2的第一步反应是:2OH-+CO2═CO32-+H2O | |
| D. | 工业上用电解固体4法制取金属5,加入冰晶石的作用是降低固体4的熔点 |
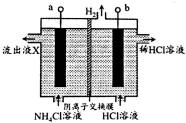 NCl3是一种黄色粘稠的油状液体(已知电负性:N>Cl)装置如图所示,利用惰性电极电解制备,原理是:NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$NCl3+3H2↑,下列说法错误的是( )
NCl3是一种黄色粘稠的油状液体(已知电负性:N>Cl)装置如图所示,利用惰性电极电解制备,原理是:NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$NCl3+3H2↑,下列说法错误的是( )| A. | b电极接电源的负极 | |
| B. | 阳极区被氧化的元素为Cl | |
| C. | 流出液X中不含HCl | |
| D. | 每生成3molH2,有6molCl-通过阴离子交换膜 |
| A. | 可用热的纯碱溶液除去矿物油污渍 | |
| B. | 盐析可提蛋白质并保持其生理活性 | |
| C. | 单质硅不仅用于制造计算机芯片,也是生产太阳能电池的材料 | |
| D. | 食品脱氧剂(含铁粉、氯化钠、炭粉等)的脱氧原理与钢铁的吸氧腐蚀相同 |

| A. | M极连接直流电源的正极 | |
| B. | 阳极上的电极反应为:NO-3e-+4OH-=NO3-+2H2O | |
| C. | 为使电解产物全部转化为NH4NO3浓溶液,需补充的物质X,则X为NH3 | |
| D. | 装置中加入稀NH4NO3溶液的目的是为了提高溶液的导电能力,可用NaNO3溶液代替 |
| 阳离子 | K+、NH4+、Fe3+、Ba2+ |
| 阴离子 | Cl-、Br-、CO32-、HCO3-、SO32-、SO42- |
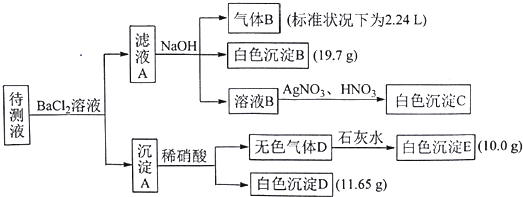
| A. | 向溶液B中加AgNO3与HNO3的操作不是多余的,待测液除含有Na+外,一定含有K+、NH4+、CO32-、HCO3-且c(K+)≥0.1mol•L-1 | |
| B. | 生成白色沉淀B的离子方程式为:Ba2++HCO3-+OH-═BaCO3↓+H2O | |
| C. | 若无色气体D是单一气体,则原溶液中c(SO42-)=0.05 mol•L-1 | |
| D. | 若无色气体D是混合气体,则沉淀A的成分是BaCO3、BaSO3、BaSO4 |
| A. | 2:7 | B. | 7:15 | C. | 3:8 | D. | 1:5 |
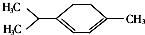 青蒿素是抗疟特效药属于萜类化合物,如图所示有机物也属于萜类化合物,关于该有机物的有关说法正确的是( )
青蒿素是抗疟特效药属于萜类化合物,如图所示有机物也属于萜类化合物,关于该有机物的有关说法正确的是( )| A. | 该有机物的一氯取代物有(不含立体异构)8种 | |
| B. | 该有机物位于同一平面内的碳原子最多有10个 | |
| C. | 该有机物难溶于水,可发生加成、氧化和聚合反应 | |
| D. | 该有机物的最简式为C5H8,与甲苯互为同系物 |