题目内容
6.下列实验装置能达到相应实验目的是( )| A. | 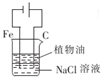 用图装置制取Fe(OH)2沉淀 | B. | 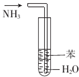 用图装置吸收NH3并防止倒吸 | ||
| C. | 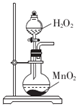 用图装置制取少量氧气 | D. | 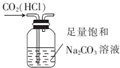 用图装置除去CO2中含有的少量HCl |
分析 A.铁为阴极,不能被氧化;
B.氨气易溶于水,不能起到防止倒吸的作用;
C.过氧化氢在二氧化锰的催化作用下可生成氧气;
D.二者都与碳酸钠溶液反应.
解答 解:A.铁为阴极,不能被氧化,如制备氢氧化亚铁,铁为阳极,被氧化生成亚铁离子,阴极生成氢氧根离子,可生成氢氧化亚铁,汽油可隔绝空气,可用于制备氢氧化亚铁,故A错误;
B.氨气易溶于水,且直接通入水中,不能起到防止倒吸的作用,应用四氯化碳,故B错误;
C.过氧化氢在二氧化锰的催化作用下可生成氧气,题给装置可用于制备氧气,故C正确;
D.二者都与碳酸钠溶液反应,应用饱和碳酸氢钠溶液,故D错误.
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质制备、气体的收集、尾气处理及分离与提纯等,侧重实验基本操作和实验原理的考查,注意装置的作用及实验的操作性、评价性分析,题目难度不大.

练习册系列答案
相关题目
20.氨基甲酸铵(NH2COONH4)是一种白色固体,受热易分解.某小组模拟制备氨基甲酸铵,反应如下:2NH3(g)+CO2(g)?NH2COONH4(s)△H<0
(1)如用下图I装置制取氨气,锥形瓶中可选择的试剂是氢氧化钠固体(或浓氨水与碱石灰或浓氨水与生石灰)等.
(2)制备氨基甲酸铵的装置如图Ⅱ所示,把NH3和CO2通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵的小晶体悬浮在CCl4中.当悬浮物较多时,停止制备.
干燥的NH3液体石蜡鼓泡瓶电动搅拌器ⅢCCl4尾气处理冰水液体石蜡鼓泡瓶干燥的CO2
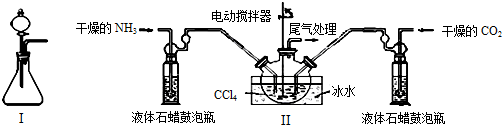
注:CCl4与液体石蜡均为惰性介质.
①图I中滴加液体的仪器名称是分液漏斗,液体石蜡鼓泡瓶的作用是通过观察气泡,调节NH3与CO2通入比例(或通过观察气泡,控制NH3与CO2的反应速率),发生器用冰水冷却的原因是降低温度,提高反应物转化率(或降低温度,防止因反应放热造成产物分解).
②从反应后的混合物中分离出产品的实验方法是过滤(填写操作名称),为了得到干燥产品,应采取的方法是b(填写选项序号).
a.常压加热烘干b.减压40℃以下烘干c.高压加热烘干
(3)制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种.
①设计方案,进行成分探究,请填写表中空格.限选试剂:蒸馏水、稀HNO3、BaCl2溶液、Ba(OH)2溶液、AgNO3溶液、稀盐酸.
②根据①的结论:取氨基甲酸铵样品3.91g,用足量氢氧化钡溶液充分处理后,过滤、洗涤、干燥,测得沉淀质量为1.97g.则样品中氨基甲酸铵的质量分数为75.4%.[Mr(NH2COONH4)=78、Mr(NH4HCO3)=79、Mr((NH4)2CO3)=96、Mr(BaCO3)=197].
(1)如用下图I装置制取氨气,锥形瓶中可选择的试剂是氢氧化钠固体(或浓氨水与碱石灰或浓氨水与生石灰)等.
(2)制备氨基甲酸铵的装置如图Ⅱ所示,把NH3和CO2通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵的小晶体悬浮在CCl4中.当悬浮物较多时,停止制备.
干燥的NH3液体石蜡鼓泡瓶电动搅拌器ⅢCCl4尾气处理冰水液体石蜡鼓泡瓶干燥的CO2

注:CCl4与液体石蜡均为惰性介质.
①图I中滴加液体的仪器名称是分液漏斗,液体石蜡鼓泡瓶的作用是通过观察气泡,调节NH3与CO2通入比例(或通过观察气泡,控制NH3与CO2的反应速率),发生器用冰水冷却的原因是降低温度,提高反应物转化率(或降低温度,防止因反应放热造成产物分解).
②从反应后的混合物中分离出产品的实验方法是过滤(填写操作名称),为了得到干燥产品,应采取的方法是b(填写选项序号).
a.常压加热烘干b.减压40℃以下烘干c.高压加热烘干
(3)制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种.
①设计方案,进行成分探究,请填写表中空格.限选试剂:蒸馏水、稀HNO3、BaCl2溶液、Ba(OH)2溶液、AgNO3溶液、稀盐酸.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解. | 得到无色溶液 |
| 步骤2:向试管中加入过量的BaCl2溶液,静置. | 溶液变浑浊,则证明固体中含有(NH4)2CO3. |
| 步骤3:取步骤2的上层清液于试管中加入少量的Ba(OH)2溶液. | 溶液不变浑浊,则证明固体中不含有NH4HCO3. |
1.下列说法正确的是( )
| A. | 电负性较大的元素在化合物中只能形成负价,不能形成正价 | |
| B. | 若元素X的第一电离能比元素Y的第一电离能小,则X的金属活动性不一定强于Y | |
| C. | H元素与F元素的电负性差值达1.9,所以HF属于离子化合物 | |
| D. | 某元素原子外围电子排布式为3d64s2,则此元素可能易显+2和+3价,且+3价稳定 |
1.现有氧化银、氧化镁、氧化铝的混合物,按如图所示的方法制取金属单质,下列叙述不正确的是( )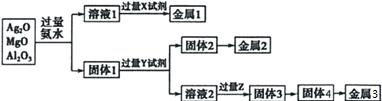

| A. | 可利用淀粉水解产生的X试剂与溶液1反应制金属1 | |
| B. | Y试剂可通过氯碱工业制得 | |
| C. | 过量Z与溶液2的第一步反应是:2OH-+CO2═CO32-+H2O | |
| D. | 工业上用电解固体4法制取金属5,加入冰晶石的作用是降低固体4的熔点 |
11.设NA表示阿伏加德罗常数,下列说法正确的是 ( )
| A. | 等质量的O2和O3在相同条件下所占的体积相同 | |
| B. | 电解精炼铜时,若转移6.02×1023个电子,则阳极溶解32g铜 | |
| C. | 1molCl2溶于足量水中,转移的电子数为NA | |
| D. | 2L 0.2mol•L-1硝酸与适量铁恰好完全反应(还原产物为NO),生成NO的分子数目为0.1NA |
18.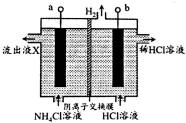 NCl3是一种黄色粘稠的油状液体(已知电负性:N>Cl)装置如图所示,利用惰性电极电解制备,原理是:NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$NCl3+3H2↑,下列说法错误的是( )
NCl3是一种黄色粘稠的油状液体(已知电负性:N>Cl)装置如图所示,利用惰性电极电解制备,原理是:NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$NCl3+3H2↑,下列说法错误的是( )
 NCl3是一种黄色粘稠的油状液体(已知电负性:N>Cl)装置如图所示,利用惰性电极电解制备,原理是:NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$NCl3+3H2↑,下列说法错误的是( )
NCl3是一种黄色粘稠的油状液体(已知电负性:N>Cl)装置如图所示,利用惰性电极电解制备,原理是:NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$NCl3+3H2↑,下列说法错误的是( )| A. | b电极接电源的负极 | |
| B. | 阳极区被氧化的元素为Cl | |
| C. | 流出液X中不含HCl | |
| D. | 每生成3molH2,有6molCl-通过阴离子交换膜 |
15.工业上用惰性电极电解NO制备NH4NO3,其工作原理如图所示,下列说法正确的是( )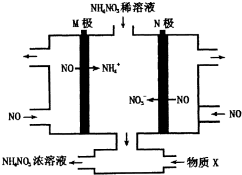

| A. | M极连接直流电源的正极 | |
| B. | 阳极上的电极反应为:NO-3e-+4OH-=NO3-+2H2O | |
| C. | 为使电解产物全部转化为NH4NO3浓溶液,需补充的物质X,则X为NH3 | |
| D. | 装置中加入稀NH4NO3溶液的目的是为了提高溶液的导电能力,可用NaNO3溶液代替 |
16.短周期主族元素X、Y、Z在元素周期表中的相对位置如图所示.下列说法一定正确的是( )


| A. | 最高正化合价:Z>X | |
| B. | X、Y、Z的单质中,Z单质的熔点最高 | |
| C. | 若X为非金属元素,则离子半径:Xn->Ym->Zm- | |
| D. | X最高价氧化物对应的水化物,要么是强酸,要么是强碱 |

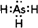 .
.