题目内容
8.从环己烷可制备1,4-环己二醇,下列有关7步反应(其中无机产物都已略去),其中有2步属于取代反应,2步属于消去反应,3步属于加成反应.试回答: $→_{①}^{Cl_{2},光照}$
$→_{①}^{Cl_{2},光照}$ $→_{△②}^{NaOH醇溶液}$A$→_{③}^{Cl_{2},不见光}$B$\stackrel{④}{→}$
$→_{△②}^{NaOH醇溶液}$A$→_{③}^{Cl_{2},不见光}$B$\stackrel{④}{→}$ $\stackrel{⑤}{→}$
$\stackrel{⑤}{→}$ $\stackrel{⑥}{→}$$→_{H_{2}}^{⑦}$
$\stackrel{⑥}{→}$$→_{H_{2}}^{⑦}$
(1)化合物的结构简式:B
 ,C
,C
(2)反应⑥所用试剂和条件是氢氧化钠的水溶液、加热
(3)反应⑤的方程式是
 .
.
分析 环己烷和氯气发生取代反应生成 ,
, 在氢氧化钠的醇溶液、加热条件下发生消去反应生成A,则A的结构简式为:
在氢氧化钠的醇溶液、加热条件下发生消去反应生成A,则A的结构简式为: ,A和氯气反应生成B,B发生消去反应生成
,A和氯气反应生成B,B发生消去反应生成 ,所以B的结构简式为
,所以B的结构简式为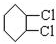 ,则A和氯气发生加成反应生成B,
,则A和氯气发生加成反应生成B, 和溴发生1,4-加成反应生成
和溴发生1,4-加成反应生成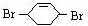 ,
,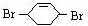 在氢氧化钠的水溶液、加热条件下发生取代反应生成C为
在氢氧化钠的水溶液、加热条件下发生取代反应生成C为 ,
, 和氢气发生加成反应生成
和氢气发生加成反应生成 ,以此解答该题.
,以此解答该题.
解答 解:环己烷和氯气发生取代反应生成 ,
, 在氢氧化钠的醇溶液、加热条件下发生消去反应生成A,则A的结构简式为:
在氢氧化钠的醇溶液、加热条件下发生消去反应生成A,则A的结构简式为: ,A和氯气反应生成B,B发生消去反应生成
,A和氯气反应生成B,B发生消去反应生成 ,所以B的结构简式为
,所以B的结构简式为 ,则A和氯气发生加成反应生成B,
,则A和氯气发生加成反应生成B, 和溴发生1,4-加成反应生成
和溴发生1,4-加成反应生成 ,
, 在氢氧化钠的水溶液、加热条件下发生取代反应生成C为
在氢氧化钠的水溶液、加热条件下发生取代反应生成C为 ,
, 和氢气发生加成反应生成
和氢气发生加成反应生成 ,
,
(1)根据上面的分析可知,B的结构简式为 ,C为
,C为 ,
,
故答案为: ;
; ;
;
(2)反应⑥为 在氢氧化钠的水溶液、加热条件下发生取代反应生成C为
在氢氧化钠的水溶液、加热条件下发生取代反应生成C为 ,所用试剂和条件是,
,所用试剂和条件是,
故答案为:氢氧化钠的水溶液、加热;
(3)反应⑤为 和溴水发生1,4加成生成
和溴水发生1,4加成生成 ,反应方程式为
,反应方程式为 ,
,
故答案为: .
.
点评 本题考查有机物推断,为高考常见题型和高频考点,涉及环烷烃、氯代烃、环烯烃、醇之间的转化,明确物质的官能团及其性质是解本题关键,采用正逆结合的方法进行推断,注意反应条件,反应条件不同会导致其产物不同.

练习册系列答案
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
18.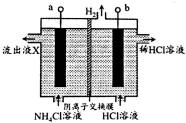 NCl3是一种黄色粘稠的油状液体(已知电负性:N>Cl)装置如图所示,利用惰性电极电解制备,原理是:NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$NCl3+3H2↑,下列说法错误的是( )
NCl3是一种黄色粘稠的油状液体(已知电负性:N>Cl)装置如图所示,利用惰性电极电解制备,原理是:NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$NCl3+3H2↑,下列说法错误的是( )
 NCl3是一种黄色粘稠的油状液体(已知电负性:N>Cl)装置如图所示,利用惰性电极电解制备,原理是:NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$NCl3+3H2↑,下列说法错误的是( )
NCl3是一种黄色粘稠的油状液体(已知电负性:N>Cl)装置如图所示,利用惰性电极电解制备,原理是:NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$NCl3+3H2↑,下列说法错误的是( )| A. | b电极接电源的负极 | |
| B. | 阳极区被氧化的元素为Cl | |
| C. | 流出液X中不含HCl | |
| D. | 每生成3molH2,有6molCl-通过阴离子交换膜 |
19.在FeCl3和CuCl2的混合溶液中加入ag铁屑充分反应后,过滤出ag固体,则原溶液中FeCl3和CuCl2的物质的量之比不可能是( )
| A. | 2:7 | B. | 7:15 | C. | 3:8 | D. | 1:5 |
16.短周期主族元素X、Y、Z在元素周期表中的相对位置如图所示.下列说法一定正确的是( )


| A. | 最高正化合价:Z>X | |
| B. | X、Y、Z的单质中,Z单质的熔点最高 | |
| C. | 若X为非金属元素,则离子半径:Xn->Ym->Zm- | |
| D. | X最高价氧化物对应的水化物,要么是强酸,要么是强碱 |
3.下列表示对应化学反应的离子方程式正确的是( )
| A. | 等物质的量的MgCl2、Ba(OH)2和HCl溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| B. | 用两个铜电极电解CuSO4 溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$ 2Cu↓+O2↑+4H+ | |
| C. | 硫酸氢钠溶液与氢氧化钡溶液恰好反应呈中性:H++SO42-+Ba2++OH-═H2O+BaSO4↓ | |
| D. | 向含有0.1 mol溶质的硫酸亚铁稀溶液中加入7.8 g Na2O2:4Na2O2+4Fe2++6H2O═4Fe(OH)3+8Na++O2↑ |
13.化学与人类生产、生活、社会可持续发展密切相关.下列说法正确的是( )
| A. | 鼓励使用太阳能、风能等淸洁能源能减少PM2.5的污染 | |
| B. | 用含有橙色酸性K2Cr207的仪器检验酒驾,利用了乙醇的挥发性和氧化性 | |
| C. | 粮食酿酒的制造原理为淀粉水解变成葡萄糖,葡萄糖再水解得到酒精 | |
| D. | 与铜质水龙头连接处的钢质水管易发生析氢腐蚀 |
20.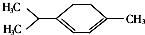 青蒿素是抗疟特效药属于萜类化合物,如图所示有机物也属于萜类化合物,关于该有机物的有关说法正确的是( )
青蒿素是抗疟特效药属于萜类化合物,如图所示有机物也属于萜类化合物,关于该有机物的有关说法正确的是( )
 青蒿素是抗疟特效药属于萜类化合物,如图所示有机物也属于萜类化合物,关于该有机物的有关说法正确的是( )
青蒿素是抗疟特效药属于萜类化合物,如图所示有机物也属于萜类化合物,关于该有机物的有关说法正确的是( )| A. | 该有机物的一氯取代物有(不含立体异构)8种 | |
| B. | 该有机物位于同一平面内的碳原子最多有10个 | |
| C. | 该有机物难溶于水,可发生加成、氧化和聚合反应 | |
| D. | 该有机物的最简式为C5H8,与甲苯互为同系物 |
17.在FeSO4溶液中加入(NH4)2SO4固体可制备硫酸亚铁铵晶体[(NH4)2S4•FeSO4•6H2O],该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇.
(1)配制FeSO4溶液时需要加入少量稀硫酸的目的是抑制FeSO4的水解,判断FeSO4溶液是否变质的方法是取适量FeSO4溶液于试管中,向溶液中加入KSCN溶液,若溶液变红,则说明FeSO4溶液变质,无现象则不变质.
(2)实验室通常向FeSO4溶液中加入饱和(NH4)2SO4溶液,然后经过“一系列操作”后得到硫酸亚铁铵晶体,其中“一系列操作”依次为蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(3)为了洗涤硫酸亚铁铵晶体的粗产品,下列方法中最合适的是d(填字母).
a.用冷水洗 b.先用冷水洗,后用无水乙醇洗
c.用Na2SO4熔液洗 d.用无水乙醇洗
(4)为了测定硫酸亚铁晶体产品的纯度,称取ag产品溶于水,配制成500mL溶液,取待测液25.00mL
用浓度为cmol•L-1的酸性KMnO4溶液滴定.重复上述操作2次,实验结果如下:
①滴定过程中发生反应的离子方程式为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O.
②滴定终点的现象是最后一滴滴入,溶液由无色变为浅紫色,且30s不变色,.
③该产品的纯度为$\frac{980c}{a}$×100%(用含a、c的代数式表示).
④上表中第一次实验记录的数据明显大于后两次,其原因可能是bc(填字母).
a.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
b.滴定前滴定管尖嘴有气泡,滴定结束无气泡
c.第一次滴定用的锥形瓶用待装液润洗过,后两次来润洗
d.该酸性高锰酸钾标准液未用硫酸酸化,改用硝酸酸化.
(1)配制FeSO4溶液时需要加入少量稀硫酸的目的是抑制FeSO4的水解,判断FeSO4溶液是否变质的方法是取适量FeSO4溶液于试管中,向溶液中加入KSCN溶液,若溶液变红,则说明FeSO4溶液变质,无现象则不变质.
(2)实验室通常向FeSO4溶液中加入饱和(NH4)2SO4溶液,然后经过“一系列操作”后得到硫酸亚铁铵晶体,其中“一系列操作”依次为蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(3)为了洗涤硫酸亚铁铵晶体的粗产品,下列方法中最合适的是d(填字母).
a.用冷水洗 b.先用冷水洗,后用无水乙醇洗
c.用Na2SO4熔液洗 d.用无水乙醇洗
(4)为了测定硫酸亚铁晶体产品的纯度,称取ag产品溶于水,配制成500mL溶液,取待测液25.00mL
用浓度为cmol•L-1的酸性KMnO4溶液滴定.重复上述操作2次,实验结果如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液的体积/ml | 25.52 | 25.02 | 24.98 |
②滴定终点的现象是最后一滴滴入,溶液由无色变为浅紫色,且30s不变色,.
③该产品的纯度为$\frac{980c}{a}$×100%(用含a、c的代数式表示).
④上表中第一次实验记录的数据明显大于后两次,其原因可能是bc(填字母).
a.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
b.滴定前滴定管尖嘴有气泡,滴定结束无气泡
c.第一次滴定用的锥形瓶用待装液润洗过,后两次来润洗
d.该酸性高锰酸钾标准液未用硫酸酸化,改用硝酸酸化.
18. 短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L-1r溶液的pH为2,s通常是难溶于水的混合物.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L-1r溶液的pH为2,s通常是难溶于水的混合物.上述物质的转化关系如图所示.下列说法正确的是( )
 短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L-1r溶液的pH为2,s通常是难溶于水的混合物.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L-1r溶液的pH为2,s通常是难溶于水的混合物.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径的大小W<X<Y | B. | 元素的非金属性Z>X>Y | ||
| C. | Y的氢化物常温常压下为液态 | D. | X的最高价氧化物的水化物为强酸 |