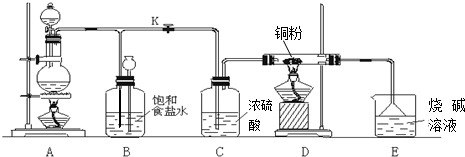
题目内容
14.称取0.4g不纯的无水碳酸钠(杂质不与酸、碱反应),加入50mL 0.1mol/L硫酸溶液,加热,溶液呈酸性,再加入0.1mol/L烧碱溶液40mL恰好中和.求:(1)上述过程中产生的CO2的体积是多少毫升(标准状态下)?
(2)无水碳酸钠的纯度.
分析 (1)整个过程最终生成为Na2SO4,根据钠离子守恒可知:2n(Na2SO4)=2n(Na2CO3)+n(NaOH),据此计算n(Na2CO3),再根据碳元素守恒计算n(CO2),根据V=nVm计算CO2的体积;
(2)根据m=nM计算Na2CO3的质量,进而计算样品中无水碳酸钠的纯度.
解答 解:(1)整个过程最终生成为Na2SO4,根据钠离子守恒可知:2n(Na2SO4)=2n(Na2CO3)+n(NaOH),则:
2×0.05L×0.1mol/L=2n(Na2CO3)+0.04L×0.1mol/L,
解得n(Na2CO3)=0.003mol,
根据碳元素守恒,可知n(CO2)=n(Na2CO3)=0.003mol,故V(CO2)=0.003L×22.4L/mol=0.0672L=67.2mL,
答:标况下生成二氧化碳的体积为67.2mL;
(2)Na2CO3的质量=0.003mol×106g/mol=0.318g,故样品中无水碳酸钠的纯度=$\frac{0.318g}{0.4g}$×100%=79.5%,
答:样品中无水碳酸钠的纯度为79.5%.
点评 本题考查化学方程式的有关计算,明确发生的反应是解题关键,本题利用守恒思想解答,避免利用方程式计算的繁琐,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.防治禽流感的重要措施之一是迅速、高效灭绝病毒.下列物质不能作为疫区杀菌消毒剂的是( )
| A. | 甲醛 | B. | 生石灰 | C. | 过氧化氢 | D. | 次氯酸钠 |
5.近年来,城市雾霾现象频繁.从物质分类来看雾霾属于胶体,它区别于溶液等其它分散系的本质特征是( )
| A. | 胶粒可以导电 | B. | 胶体是混合物 | ||
| C. | 胶体的分散剂为气体 | D. | 胶体粒子大小在1~100nm 之间 |
2.下列实验“操作和现象”与“结论”都正确的是( )
| 操作和现象 | 结论 | |
| A | 切开金属钠,钠表面银白色会逐渐褪去 | Na在空气中会生成Na2O2 |
| B | 铁棒插入浓硝酸中,无明显现象 | 铁与浓硝酸不反应 |
| C | 将FeCl2溶液滴加到少许酸性KMnO4溶液中,溶液褪色 | FeCl2具有漂白性 |
| D | 向Fe(NO3)2溶液中滴加稀硫酸和KSCN溶液,溶液变成红色 | 原溶液中可能含有Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
6.CO2是最常见的酸性氧化物之一,实验室用一定浓度的NaOH溶液吸收二氧化碳可以得到相应的盐溶液.某实验兴趣小组对该反应的产物成分进行探究:
Ⅰ.①取反应后溶液少许于试管中,滴入几滴酚酞试液,溶液变红.
甲同学认为一定是剩余氢氧化钠使溶液显碱性.
乙同学不同意他的看法,理由是:CO32-+H2O?HCO3-+OH-(或HCO3-+H2O?H2CO3+OH-)(用离子方程式表示).
丙同学为了验证甲乙两位同学的观点,设计了如下实验:取少量一定浓度的NaOH溶液并向溶液中通入过量CO2,再向反应后的溶液中滴入酚酞,溶液仍然变红.(不考虑CO2溶解),请将该溶液中所有离子的浓度由大到小排列:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
②若反应后的溶液中只有一种酸式盐,请设计实验证明该结论.
提供试剂:稀盐酸,Ba(OH)2溶液,BaCl2溶液,酚酞,澄清石灰水,MgCl2溶液,NaOH溶液
Ⅱ.有同学认为SO2与CO2相似也可以与NaOH溶液反应.实验发现将过量SO2通入少量一定浓度的NaOH溶液,所得溶液能使pH试纸变红.(不考虑SO2溶解)
请将该溶液中所有离子的浓度由大到小排列:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH- ).
Ⅰ.①取反应后溶液少许于试管中,滴入几滴酚酞试液,溶液变红.
甲同学认为一定是剩余氢氧化钠使溶液显碱性.
乙同学不同意他的看法,理由是:CO32-+H2O?HCO3-+OH-(或HCO3-+H2O?H2CO3+OH-)(用离子方程式表示).
丙同学为了验证甲乙两位同学的观点,设计了如下实验:取少量一定浓度的NaOH溶液并向溶液中通入过量CO2,再向反应后的溶液中滴入酚酞,溶液仍然变红.(不考虑CO2溶解),请将该溶液中所有离子的浓度由大到小排列:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
②若反应后的溶液中只有一种酸式盐,请设计实验证明该结论.
提供试剂:稀盐酸,Ba(OH)2溶液,BaCl2溶液,酚酞,澄清石灰水,MgCl2溶液,NaOH溶液
| 实验步骤 | 预期现象和结论 |
请将该溶液中所有离子的浓度由大到小排列:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH- ).
4.下列除杂方法合适并能成功的是( )
| 选项 | 待提纯样品(括号内为杂质) | 除杂方法或实验装置 |
| A | 淀粉胶体(KI溶液) | 过滤 |
| B | 乙酸乙酯(饱和碳酸钠溶液) | 蒸馏,收集77℃下馏分 |
| C | CO2(SO2) | 通过盛有饱和碳酸钠溶液的洗气瓶并干燥 |
| D | 氯气(氯化氢) | 通过盛有饱和食盐水的洗气瓶并干燥 |
| A. | A | B. | B | C. | C | D. | D |

 R-CH2CH2OH(B2 H6为乙硼烷)
R-CH2CH2OH(B2 H6为乙硼烷) ;
; ;
;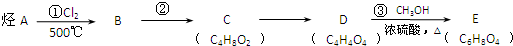
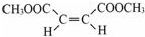 .
.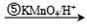 $\stackrel{⑥}{→}$$\stackrel{⑦酸化}{→}$D.则⑥所需的无机试剂及反应条件是NaOH的醇溶液、加热;④的化学方程式是
$\stackrel{⑥}{→}$$\stackrel{⑦酸化}{→}$D.则⑥所需的无机试剂及反应条件是NaOH的醇溶液、加热;④的化学方程式是 .
.