题目内容
7.把0.1mol KOH固体分别加入到下列100ml的液体中,溶液的导电能力无变化的是( )| A. | 纯净水 | B. | 0.lmol/LHCl | C. | 1.0mol/LCH3COOH | D. | 0.5mol/LH2SO4 |
分析 溶液导电能力与离子浓度成正比、与所带电荷成正比,加入0.1molKOH后,溶液导电能力无变化,说明溶液中离子浓度变化不大,据此分析解答.
解答 解:A.水是弱电解质、KOH是强电解质,水中加入KOH后,KOH电离出阴阳离子而导致溶液中离子浓度变化较大,则溶液导电能力变化较大,故A不选;
B.HCl、KOH都是强电解质,加入0.1molKOH后,二者反应生成强电解质KCl,但KOH过量,所以溶液中离子浓度增大,则溶液导电能力增强,故B不选;
C.醋酸是弱电解质、KOH是弱电解质,加入0.1molKOH后,溶液中溶质由弱电解质醋酸变为强电解质醋酸钾,溶液中离子浓度变化较大,则溶液导电能力变化较大,故C不选;
D.硫酸和KOH都是强电解质,二者混合后恰好完全反应生成强电解质硫酸钾,溶液中离子浓度无变化,则溶液导电能力无变化,故D选;
故选D.
点评 本题考查电解质溶液导电性,为高频考点,明确影响溶液导电性强弱因素是解本题关键,注意:电解质溶液导电性强弱与离子浓度有关,与电解质强弱无关,题目难度不大.

练习册系列答案
相关题目
5.如图所示,a、b是两根石墨棒,下列叙述错误的是( )


| A. | 往滤纸上滴加酚酞试液,a极附近颜色变红 | |
| B. | 锌电极上的反应:Zn-2e→Zn2+ | |
| C. | 稀硫酸中硫酸根离子的物质的量不变 | |
| D. | a是阳极,发生氧化反应 |
19.下列观点,正确的是( )
| A. | 化学研究会造成严重的环境污染,危害人们的生活 | |
| B. | 乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” | |
| C. | 用大量木材作燃料可以缓解当前能源不足问题 | |
| D. | 对于常见的大多数金属,其金属活动性越强,冶炼就越困难 |
16.将a g下列选项中的物质在足量的氧气中完全燃烧,再将产生的气体通过足量的Na2O2固体,充分反应后,固体增加的质量大于a g的是( )
| A. | CO和H2 | B. | C6H12O6 | C. | CH2O2 | D. | C2H5OH |
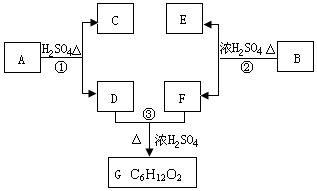 A、B、C、D、E、F和G都是有机化合物,它们的关系如图所示:
A、B、C、D、E、F和G都是有机化合物,它们的关系如图所示: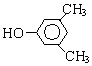 或
或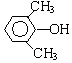 或
或 (写出一种即可).
(写出一种即可). 或
或
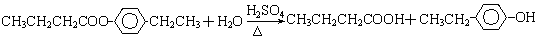 .①反应的反应类型取代反应
.①反应的反应类型取代反应 或
或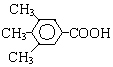 .
. .
.