题目内容
5.如图所示,a、b是两根石墨棒,下列叙述错误的是( )
| A. | 往滤纸上滴加酚酞试液,a极附近颜色变红 | |
| B. | 锌电极上的反应:Zn-2e→Zn2+ | |
| C. | 稀硫酸中硫酸根离子的物质的量不变 | |
| D. | a是阳极,发生氧化反应 |
分析 由图可知,烧杯中构成Cu、Zn原电池,电解饱和食盐水,a与Cu电解相连,则a为阳极,所以b为阴极,氢离子放电,在a极氯离子放电,结合电解原理及原电池原理来解答.
解答 解:由图可知,烧杯中构成Cu、Zn原电池,电解饱和食盐水,a与Cu电解相连,则a为阳极,所以b为阴极,在a极氯离子放电,
A.Cu为原电池的正极,a与Cu电解相连,则a为阳极,发生氧化反应,氯离子放电产生氯气,b极氢离子放电,则往滤纸上滴加酚酞试液,b极附近颜色变红,故错误;
B、Cu为原电池的正极,锌是负极,该电极上的反应:Zn-2e→Zn2+,故正确;
C.由原电池反应为Zn+2H+═Zn2++H2↑,则稀硫酸中硫酸根离子的物质的量不变,故正确;
D.a与Cu电解相连,则a为阳极,发生氧化反应,故正确.
故选A.
点评 本题考查原电池和电解池,明确图中的装置为电解池还是原电池是解答本题的关键,熟悉其工作原理即可解答,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.化学与生产、生活、环境等社会实际密切相关.下列叙述正确的是( )
| A. | “滴水石穿、绳锯木断”不涉及化学变化 | |
| B. | 氟利昂作制冷剂会加剧雾霾天气的形成 | |
| C. | 明矾净水的原理和“84”消毒液消毒的原理不相同 | |
| D. | 汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的 |
16.下列叙述正确的是( )
| A. | NH4Cl是电解质,所以NH4Cl溶液是电解质 | |
| B. | Al2O3是两性氧化物,所以它能溶解于盐酸也能溶于氨水中 | |
| C. | 用FeCl3溶液制作印刷电路板的原因是Fe3+具有氧化性 | |
| D. | Fe(OH)3胶体的本质特征是能产生丁达尔效应 |
13.某化工厂用软锰矿(含MnO2及少量Al2O3)和闪锌矿(含ZnS及少量FeS)联合生产Zn、MnO2,其部分生产流程如下:

已知:过滤(Ⅱ)所得滤液是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液.相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)如下表:
(1)加热、浸取时所加矿石均需粉碎,其目的是加快反应(浸取)速率.
(2)写出FeS和MnO2和稀硫酸反应的离子方程式:2FeS+3MnO2+12H+=2Fe3++2S↓+3Mn2++6H2O.
(3)试剂X的作用是调节溶液的pH以生成Fe(OH)3、Al(OH)3.pH调节的范围是5.2~6.4,试剂X可以选用AC(填选项字母).
A.MnCO3 B.Na2CO3 C.Zn2(OH)2CO3 D.NH3•H2O
(4)电解(Ⅴ)中阳极的电极反应式为Mn2++2H2O-2e-=MnO2+4H+.
(5)Zn和MnO2是制作电池的原料.某锌-锰碱性电池以KOH溶液为电解质溶液,其电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s).该电池的正极的电极反应式为2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-.

已知:过滤(Ⅱ)所得滤液是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液.相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)如下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 | Mn(OH)2 |
| 开始沉淀时的pH | 2.7 | 4.0 | 6.4 | 7.7 |
| 完全沉淀时的pH | 3.7 | 5.2 | 8.0 | 10.4 |
(2)写出FeS和MnO2和稀硫酸反应的离子方程式:2FeS+3MnO2+12H+=2Fe3++2S↓+3Mn2++6H2O.
(3)试剂X的作用是调节溶液的pH以生成Fe(OH)3、Al(OH)3.pH调节的范围是5.2~6.4,试剂X可以选用AC(填选项字母).
A.MnCO3 B.Na2CO3 C.Zn2(OH)2CO3 D.NH3•H2O
(4)电解(Ⅴ)中阳极的电极反应式为Mn2++2H2O-2e-=MnO2+4H+.
(5)Zn和MnO2是制作电池的原料.某锌-锰碱性电池以KOH溶液为电解质溶液,其电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s).该电池的正极的电极反应式为2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-.
20.下列各组表达式意义相同的是( )
| A. | -NO2、NO2 | B. | -OH、 | C. | -COOH、HCOO- | D. | HCOOCH3、HOOCCH3 |
10.今有一混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH4+、Ba2+、Cl-、CO32-、SO42-.现取两份200mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体1.36g;②第二份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g.根据上述实验,以下推测正确的是( )
| A. | 一定不存在Ba2+,NH4+可能存在 | B. | CO32-一定存在 | ||
| C. | Na+一定存在 | D. | 一定不存在Cl- |
17.下列说法正确的是( )
| A. | 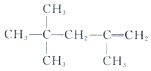 的名称为:2,2,4-三甲基-4-戊烯 的名称为:2,2,4-三甲基-4-戊烯 | |
| B. | 碳原子数小于或等于8的单烯烃,与HBr加成反应的产物只有一种结构,符合条件的单烯烃有6种 | |
| C. | 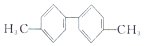 分子中至少有10个碳原子处于同一平面 分子中至少有10个碳原子处于同一平面 | |
| D. | 1 mol β-紫罗兰酮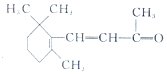 与1 mol H2发生加成反应可得到3种不同产物 与1 mol H2发生加成反应可得到3种不同产物 |
14.以苯甲醛为原料,通过Cannizzaro反应来制备苯甲醇和苯甲酸,反应式为:
主反应:

副反应:

主要物料的物理常数如表:
实验步骤:

(1)仪器A的作用是冷凝回流.
(2)蒸馏操作时温度应该控制在205℃左右.获得产品乙时进行的操作Ⅱ的名称是抽滤(过滤、减压过滤).
(3)①上层溶液1中除乙醚外主要有机杂质是苯甲醛、苯甲酸.
洗涤时先后用到了饱和NaHSO3溶液、10%的NaHCO3溶液和水.
②洗涤操作在d中进行.
a.烧杯 b.布氏漏斗 c.烧瓶 d.分液漏斗
③加入10%的NaHCO3溶液至无气泡生成(填现象)时说明杂质已被除尽.
(4)若产品甲的质量为5.40g,则产品甲的产率是66.7%.
主反应:

副反应:

主要物料的物理常数如表:
| 名称 | 分子量 | 性状 | 相对密度 (g•cm-3) | 沸点 (℃) | 溶解度 | ||
| 水 | 乙醚 | ||||||
| 苯甲醛 | 106 | 无色液体 | 1.04 | 179 | 微溶 | 易溶 | |
| 苯甲酸 | 122 | 无色晶体 | 1.27 | 249 | 0.21g | 66g | |
| 苯甲醇 | 108 | 无色液体 | 1.04 | 205 | 微溶 | 易溶 | |
| 乙醚 | 74 | 无色液体. | 0.71 | 35 | 不溶 | -- | |

(1)仪器A的作用是冷凝回流.
(2)蒸馏操作时温度应该控制在205℃左右.获得产品乙时进行的操作Ⅱ的名称是抽滤(过滤、减压过滤).
(3)①上层溶液1中除乙醚外主要有机杂质是苯甲醛、苯甲酸.
洗涤时先后用到了饱和NaHSO3溶液、10%的NaHCO3溶液和水.
②洗涤操作在d中进行.
a.烧杯 b.布氏漏斗 c.烧瓶 d.分液漏斗
③加入10%的NaHCO3溶液至无气泡生成(填现象)时说明杂质已被除尽.
(4)若产品甲的质量为5.40g,则产品甲的产率是66.7%.
7.把0.1mol KOH固体分别加入到下列100ml的液体中,溶液的导电能力无变化的是( )
| A. | 纯净水 | B. | 0.lmol/LHCl | C. | 1.0mol/LCH3COOH | D. | 0.5mol/LH2SO4 |