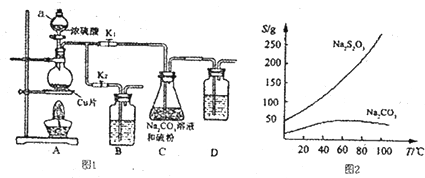
题目内容
19.用浓盐酸和二氧化锰制氯气的实验装置如图所示: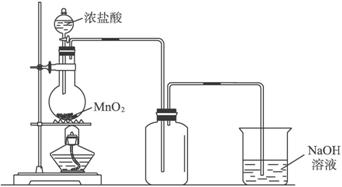
(1)下列气体实验室制备时,可以用相同发生装置的是C
A.O2 B.H2 C.HCl D.CO2
(2)制得的氯气中还含有氯化氢杂质,可通过装有饱和食盐水的洗气瓶除去.
(3)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,漂白粉在空气中很容易变质,请写出漂白粉在空气中变质的反应方程式CO2+H2O+Ca(ClO)2=CaCO3↓+2HClO,2HClO $\frac{\underline{\;光照\;}}{\;}$2HCl↑+O2↑,.据报道,日常生活中,将洁厕液(主要成分是HCl)与84消毒液(主要成分是次氯酸钠)混合使用会发生中毒的事故,生成有毒的氯气.写出反应的化学方程式NaClO+2HCl=NaCl+Cl2↑+H2O.
(4)二氧化锰和高锰酸钾都是强氧化剂,均可将浓盐酸氧化为氯气.用浓盐酸和高锰酸钾制氯气的反应方程式如下:KMnO4+HCl→KCl+MnCl2+Cl2+H2O
①配平该反应的化学方程式.
②用“单线桥”在上述程式上标出电子转移的方向和数目.
该反应中Cl元素被氧化,方程式中起酸性作用的HCl是6mol.当有1mol电子转移时,可生成气体(标准状态下)11.2升.
(5)(如图)有人做了一个改进实验.挤压软塑料瓶,向装有固体B的锥形瓶中加入溶液A,同时往燃烧管中通入气体C并点燃,可以看到明显的燃烧现象(金属网用以防止气体混合爆炸).

用此装置模拟工业合成盐酸.则相应试剂选择正确的是d(选填序号).
| 溶液A | 固体B | 气体C | |
| a | 稀硫酸 | Zn | Cl2 |
| b | 浓盐酸 | MnO2 | H2 |
| c | 稀硝酸 | Fe | Cl2 |
| d | 浓盐酸 | KMnO4 | H2 |
分析 (1)该发生装置为:固体+液态$\stackrel{△}{→}$气体;
(2)利用饱和食盐水除去HCl,可以降低氯气溶解度;
(3)氯气与氢氧化钙反应生成氯化钙、次氯酸钙与水;次氯酸钙与空气中二氧化碳、水反应生成碳酸钙、HClO,HClO在光照条件下分解为HCl与氧气;由题意可知,HCl与次氯酸钠反应生成氯化钠、氯气与水;
(4)①反应中锰元素全部被还原,锰元素化合价由+7价降低为+2价,总共降低5价,氯元素化合价由HCl中的-1升高为氯气中的0价,总共升高2价,化合价升降最小公倍数为10,高锰酸钾系数为2,氯气系数为5,再根据原子守恒配平;
②反应中转移电子数目为10,单线桥表示电子转移时,在反应物中由化合价升高的元素指向化合价降低的元素,并注明电子数目;
元素化合价升高,发生氧化反应,起酸性作用的HCl生成KCl、MnCl2,其还原剂作用的HCl生成氯气,根据电子转移守恒计算生成氯气体积;
(5)用此装置模拟工业合成盐酸,则在燃烧管口处是氢气与氯气反应生成HCl,通入气体C为氢气、锥形瓶中生成的气体为氯气,且制备氯气的反应不需要加热.
解答 解:(1)该发生装置为:固体与液态加热制备气体,与实验室制备HCl装置相同,
故选:C;
(2)饱和食盐水除去HCl,可以降低氯气溶解度,
故答案为:饱和食盐水;
(3)氯气与氢氧化钙反应生成氯化钙、次氯酸钙与水,反应方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
次氯酸钙与空气中二氧化碳、水反应生成碳酸钙、HClO,HClO在光照条件下分解为HCl与氧气,有关反应方程式为:CO2+H2O+Ca(ClO)2=CaCO3↓+2HClO,2HClO $\frac{\underline{\;光照\;}}{\;}$2HCl↑+O2↑,漂白粉失效,
由题意可知,HCl与次氯酸钠反应生成氯化钠、氯气与水,反应方程式为:NaClO+2HCl=NaCl+Cl2↑+H2O,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;CO2+H2O+Ca(ClO)2=CaCO3↓+2HClO,2HClO $\frac{\underline{\;光照\;}}{\;}$2HCl↑+O2↑;NaClO+2HCl=NaCl+Cl2↑+H2O;
(4)①反应中锰元素全部被还原,锰元素化合价由+7价降低为+2价,总共降低5价,氯元素化合价由HCl中的-1升高为氯气中的0价,总共升高2价,化合价升降最小公倍数为10,高锰酸钾系数为2,氯气系数为5,配平后反应方程式为:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O,
故答案为:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O;
②反应中转移电子数目为10,用单线桥标出电子转移为 ,反应中Cl元素化合价升高,发生氧化反应,起酸性作用的HCl生成KCl、MnCl2,起酸性作用的HCl为6mol,当有1mol电子转移时,生成氯气为$\frac{1mol}{2}$=0.5mol,生成氯气体积为0.5mol×22.4L/mol=11.2L,
,反应中Cl元素化合价升高,发生氧化反应,起酸性作用的HCl生成KCl、MnCl2,起酸性作用的HCl为6mol,当有1mol电子转移时,生成氯气为$\frac{1mol}{2}$=0.5mol,生成氯气体积为0.5mol×22.4L/mol=11.2L,
故答案为: ;Cl;6;11.2;
;Cl;6;11.2;
(5)用此装置模拟工业合成盐酸,则在燃烧管口处是氢气与氯气反应生成HCl,通入气体C具有可燃性,则C为氢气、锥形瓶中生成的气体为氯气,且制备氯气的反应不需要加热,二氧化锰和浓盐酸的反应需加热才能发,浓盐酸和高锰酸钾在不加热的条件下可以生成氯气,故d正确;
氢气在纯净的氯气中燃烧生成氯化氢,发出苍白色的火焰,氯化氢极易溶于水,在管口上分与水蒸气结合成盐酸液滴,看到白雾产生;
故答案为:d; 苍白色火焰,管口上方有白雾.
点评 本题考查氯气的制备、氧化还原反应、实验原理与装置的分析评价等,需要学生具备扎实的基础与实验分析能力,题目难度中等.

 阅读快车系列答案
阅读快车系列答案
| A. | 用图1所示装置进行浓硫酸与亚硫酸钠的反应制取并收集SO2 | |
| B. | 用图2所示装置进行研究不同催化剂对反应速率的影响 | |
| C. | 用图3所示装置比较MnO2、Cl2、I2的氧化性 | |
| D. | 用图4所示装置可以制取金属锰 |
| A | B | C | D |
 | 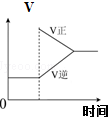 |  | 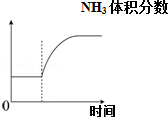 |
| 可逆反应:Cr2O72-+H2O?2CrO42-+2H+达平衡状态溶液呈橙黄色,滴加少量的浓硝酸,溶液变橙色,氢离子浓度随时间变化曲线如图 | 可逆反应Co(H2O)62+(粉红色)+4Cl-?CoCl42-(蓝色)+6H2O达平衡状态溶液呈紫色,升高温度,溶液变蓝色,反应速率随时间变化曲线如图 | 可逆反应:2NO2?N2O4达平衡状态呈红棕色,加压(缩小体积)红棕色变深,NO2物质的量随时间变化曲线如图 | 可逆反应:N2(g)+3H2(g)?2NH3(g)△H<0达平衡状态,升高温度,NH3体积分数随时间变化曲线如图 |
| A. | A | B. | B | C. | C | D. | D |
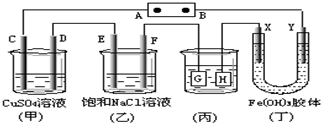 如下图所示的装置,C.D.E.F.X.Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )
如下图所示的装置,C.D.E.F.X.Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )| A. | 电源B极是正极 | |
| B. | 欲用丙装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 | |
| C. | 甲、乙装置的C、D、E、F电极均有单质生成,其物质的量之比为1:2:2:2 | |
| D. | 装置乙中E极附近产生可燃气体 |
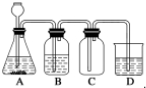
| A. | A 中可用分液漏斗代替长颈漏斗 | |
| B. | A 中缺少加热装置 | |
| C. | B 中盛放的NaOH 溶液可以净化Cl2 | |
| D. | D 中盛放的NaOH 溶液可以吸收尾气 |
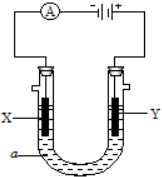 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: