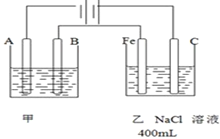
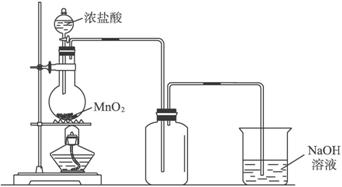
题目内容
14.如图所示是一个制取氯气并以氯气为原料进行特定反应的装置,其中各试剂瓶中所装试剂为:B(碘化钾淀粉溶液)、C(紫色石蕊试液)、D(FeCl2溶液)、E(水).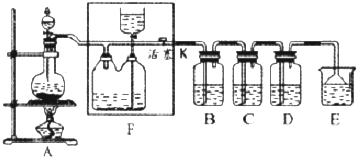
(1)若A中烧瓶中的固体为MnO2,液体为浓盐酸,则其发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)F装置的作用为储存氯气、起安全瓶作用,防止后续装置发生堵塞时装置爆炸;F装置瓶内宜加入的液体是饱和食盐水.
(3)实验开始后B中的现象是B中上部空间由无色变为黄绿色,溶液变蓝色,C中的现象是C中上部空间由无色变为黄绿色,溶液先变红色后褪色.
(4)写出D中反应的化学方程式:2FeCl2+Cl2═2FeCl3.
(5)用量筒量取20mL E中溶液,倒入已检漏的分液漏斗中,然后再注入10mL CCl4,盖好玻璃塞,振荡,静置于铁架台上,等分层后取上层液和下层液,呈黄绿色的是下层液(填“上层液”或“下层液”),再装入烧杯中,能使有色布条褪色的是上层液(填“上层液”或“下层液”).
分析 (1)浓盐酸与二氧化锰在加热条件下反应生成氯化锰、氯气与水;
(2)可以储存氯气、起安全瓶作用,防止后续装置发生堵塞时装置爆炸;
(3)B中发生反应:2KI+Cl2═I2+2KCl,碘与淀粉变蓝色,氯气充满上部空间,C中氯气与水反应生成HCl与HClO,溶液呈酸性,且HClO具有漂白性;
(4)氯气与氯化亚铁反应生成氯化铁;
(5)四氯化碳萃取氯水中的氯气,有机层在下层且为黄绿色,上层溶液中含有HClO,可以漂白有色布条.
解答 解:(1)浓盐酸与二氧化锰在加热条件下反应生成氯化锰、氯气与水,反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)可以储存氯气、起安全瓶作用,防止后续装置发生堵塞时装置爆炸,应盛放饱和食盐水,可以降低氯气溶解度,
故答案为:储存氯气、起安全瓶作用,防止后续装置发生堵塞时装置爆炸;饱和食盐水;
(3)B中发生反应:2KI+Cl2═I2+2KCl,溶液变蓝色,上部空间由无色变为黄绿色;C中氯气与水反应生成HCl与HClO,溶液呈酸性,且HClO具有漂白性,溶液先变红色后褪色,上部空间由无色变为黄绿色,
故答案为:B中上部空间由无色变为黄绿色,溶液变蓝色;C中上部空间由无色变为黄绿色,溶液先变红色后褪色;
(4)氯气与氯化亚铁反应生成氯化铁,反应方程式为:2FeCl2+Cl2═2FeCl3,
故答案为:2FeCl2+Cl2═2FeCl3;
(5)四氯化碳萃取氯水中的氯气,有机层在下层且为黄绿色,上层溶液中含有HClO,可以使有色布条褪色,
故答案为:下层液;上层液.
点评 本题综合考查氯气制备与性质实验,涉及实验原理、对装置的分析与评价、萃取等,侧重于学生的分析能力、实验能力的考查,难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 溶液中溶质微粒一定不带电,胶体中分解质微粒带有电荷 | |
| B. | 溶液呈电中性,胶体带电荷 | |
| C. | 胶体是比溶液更稳定的分散系 | |
| D. | 胶体是一种较稳定的分散系 |
(1)CO可用于炼铁,
已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
C(s)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol.
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液).写出该电池的正极反应式:O2+4e-+2H2O=4OH-.
(3)CO2和H2充人一定体积的密闭容器中,在两种温度下发生反应:
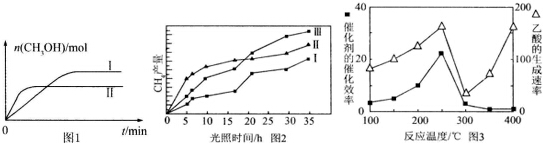
CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CH3OH的物质的量随时间的变化见图1.
①线Ⅰ、Ⅱ对应的平衡常数大小关系为KI>KⅡ (填“>”或“=”或“<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2、3mol H2 | a mol CO2、b mol H2、 c mol CH3OH(g)、c molH2O(g) |
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,在不同催化
剂(Ⅰ、Ⅱ,Ⅲ)作用下,CH4产量随光照时间的变化见图2.在O~15小时内,CH4的平均生成速率Ⅰ、Ⅱ和Ⅲ从大到小的顺序为II>III>I(填序号).
(5)以TiO2/Cu2Al2O4 为催化剂,可以将CO2和CH4直接转化成乙酸.在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图3.
①乙酸的生成速率主要取决于温度影响的范围是300℃~400℃.
②Cu2Al2O4可溶于稀硝酸,写出有关的离子方程式:3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.
| A. | 配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近标线1cm~2cm处,用滴管滴加蒸馏水到标线 | |
| B. | 容量瓶用蒸馏水洗净后,再用待配溶液润洗 | |
| C. | 配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1cm~2cm处,用滴管滴加蒸馏水到标线 | |
| D. | 使用容量瓶前检查它是否漏水 |
⑦氨水 ⑧稀硝酸 ⑨KI
(1)按物质的分类方法填写表格的空白处(填物质编号)
| 分类标准 | 电解质 | 盐 | 非电解质 | 混合物 |
| 属于该类 的物质 |
H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ•mol-1,又知在溶液中反应有:
CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l);△H=-Q1kJ•mol-1,
$\frac{1}{2}$H2SO4(浓)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l);△H=-Q2 kJ•mol-1
HNO3(aq)+KOH(aq)═KNO3(aq)+H2O(l);△H=-Q3 kJ•mol-1,
则Q1、Q2、Q3的关系正确的是( )
| A. | Q1=Q2=Q3 | B. | Q2>Q1>Q3 | C. | Q2>Q3>Q1 | D. | Q2=Q3>Q1 |