题目内容
11.原电池的正极得到(填“得到”或“失去”)电子,发生还原(填“氧化”或“还原”)反应;负极失去(填“得到”或“失去”)电子,发生氧化(填“氧化”或“还原”)反应.分析 原电池是把化学能转变为电能的装置,原电池放电时,负极上失去电子发生氧化反应,即电子流出的是负极,正极上得电子发生还原反应,电子从负极流向正极,以此解答.
解答 解:原电池工作时,原电池的正极得到电子,发生还原反应;负极失去电子,发生氧化反应.
故答案为:得到;还原;失去;氧化.
点评 本题考查原电池知识,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,难度不大,注意把握原电池的工作原理.

练习册系列答案
相关题目
6.现有下列物质:①Na2CO3 ②铜 ③氯化氢 ④CO2⑤NaHSO4 ⑥Ba(OH)2
⑦氨水 ⑧稀硝酸 ⑨KI
(1)按物质的分类方法填写表格的空白处(填物质编号)
(2)物质⑨的稀溶液在空气中被氧化,加入淀粉溶液显蓝色,则反应的离子方程式为O2+4I-+2H2O═2I2+4OH-.
⑦氨水 ⑧稀硝酸 ⑨KI
(1)按物质的分类方法填写表格的空白处(填物质编号)
| 分类标准 | 电解质 | 盐 | 非电解质 | 混合物 |
| 属于该类 的物质 |
16.某原电池的总反应是Zn+Cu2+═Zn2++Cu,则该原电池的组成正确的是( )
| A | B | C | D | |
| 正极 | Zn | Fe | 碳棒 | Cu |
| 负极 | 碳棒 | Zn | Zn | Zn |
| 电解质溶液 | CuCl2 | H2SO4 | CuSO4 | ZnCl2 |
| A. | A | B. | B | C. | C | D. | D |
1.下列叙述正确的是( )
| A. | 合金中至少含有两种金属 | |
| B. | 漂白粉能在空气中长期存放 | |
| C. | 工艺师利用氢氟酸刻蚀石英制作艺术品 | |
| D. | NaOH溶液保存在配有磨口玻璃塞的细口试剂瓶中 |

 +(n-1)H2O→n HOOCCH2CH(OH)COOH.
+(n-1)H2O→n HOOCCH2CH(OH)COOH.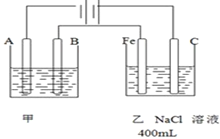
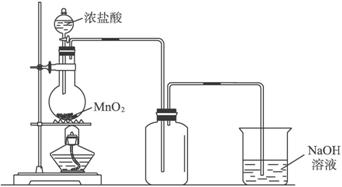

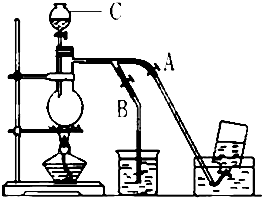 如图表示在没有通风橱的条件下制备氯气时设计的装置,图中a、b是可控制的弹簧铁夹.(氯气在饱和氯化钠溶液中的溶解度较小.)
如图表示在没有通风橱的条件下制备氯气时设计的装置,图中a、b是可控制的弹簧铁夹.(氯气在饱和氯化钠溶液中的溶解度较小.)