题目内容
下列是元素周期表的一部分,针对表中8种元素,填写以下空白.
(1)F-离子结构示意图 .
(2)金属性质最活泼的是 (填元素符号).
(3)CH4与HF中,较不稳定的是 .
(4)Na、Mg、Al元素中原子半径最小的是 .
(5)H2CO3与H2SO4中,酸性较弱的是 .
(6)Al2O3与NaOH溶液反应的化学方程式为 .
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | F | Ne | |||||
| 3 | Na | Mg | Al | Si | Cl |
(2)金属性质最活泼的是
(3)CH4与HF中,较不稳定的是
(4)Na、Mg、Al元素中原子半径最小的是
(5)H2CO3与H2SO4中,酸性较弱的是
(6)Al2O3与NaOH溶液反应的化学方程式为
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:(1)F-离子核外有10个电子、2个电子层,最外层电子数是8,据此书写氟离子结构示意图;
(2)金属性质最活泼的元素在周期表左下角;
(3)元素的非金属性越强,其氢化物越稳定;
(4)同一周期元素中,原子半径随着原子序数的增大而减小;
(5)元素的非金属性越强,其最高价氧化物的水化物酸性越强;
(6)Al2O3与NaOH溶液反应生成偏铝酸钠和水.
(2)金属性质最活泼的元素在周期表左下角;
(3)元素的非金属性越强,其氢化物越稳定;
(4)同一周期元素中,原子半径随着原子序数的增大而减小;
(5)元素的非金属性越强,其最高价氧化物的水化物酸性越强;
(6)Al2O3与NaOH溶液反应生成偏铝酸钠和水.
解答:
解:(1)F-离子核外有10个电子、2个电子层,最外层电子数是8,氟离子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)金属性质最活泼的元素在周期表左下角,所以金属性质最活泼的是Na,故答案为:Na;
(3)元素的非金属性越强,其氢化物越稳定,C的非金属性小于F元素,所以CH4与HF中,较不稳定的是CH4,故答案为:CH4;
(4)同一周期元素中,原子半径随着原子序数的增大而减小,所以Na、Mg、Al元素中原子半径最小的是Al,故答案为:Al;
(5)元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性C<S,所以H2CO3与H2SO4中,酸性较弱的是H2CO3,故答案为:H2CO3;
(6)Al2O3与NaOH溶液反应生成偏铝酸钠和水,反应方程式为Al2O3+2NaOH=2NaAlO2+H2O,故答案为:Al2O3+2NaOH=2NaAlO2+H2O.
 ,故答案为:
,故答案为: ;
;(2)金属性质最活泼的元素在周期表左下角,所以金属性质最活泼的是Na,故答案为:Na;
(3)元素的非金属性越强,其氢化物越稳定,C的非金属性小于F元素,所以CH4与HF中,较不稳定的是CH4,故答案为:CH4;
(4)同一周期元素中,原子半径随着原子序数的增大而减小,所以Na、Mg、Al元素中原子半径最小的是Al,故答案为:Al;
(5)元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性C<S,所以H2CO3与H2SO4中,酸性较弱的是H2CO3,故答案为:H2CO3;
(6)Al2O3与NaOH溶液反应生成偏铝酸钠和水,反应方程式为Al2O3+2NaOH=2NaAlO2+H2O,故答案为:Al2O3+2NaOH=2NaAlO2+H2O.
点评:本题考查了元素周期表和元素周期律的综合应用,根据原子结构、元素周期律、物质的性质来分析解答即可,注意基础知识的积累,并灵活运用知识解答问题,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
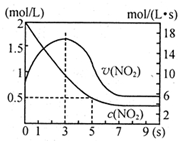 某绝热恒容容器中充入2mol/L NO2,发生反应2NO2?N2O4 △H=-56.9kJ/mol下列分析不正确的是( )
某绝热恒容容器中充入2mol/L NO2,发生反应2NO2?N2O4 △H=-56.9kJ/mol下列分析不正确的是( )| A、5s时NO2的转化率为75% |
| B、0-3s时v(NO2)增大是由于体系温度升高 |
| C、3s时化学反应处于平衡状态 |
| D、9s时再充入N2O4,平衡后K较第一次平衡时大 |
某溶液中可能含有下列5中离子中的某几种:Na+、NH4+、Mg2+、Al3+、Cl-.为确认该溶液组成进行如下实验:①取20.0ml该溶液,加入25.0ml4.00mol/LNaOH溶液,有白色沉淀、无刺激气味气体生成.过滤、洗涤、干燥,得沉淀1.16g.再将滤液稀释至100ml,测得滤液中c(OH-)为0.20mol/L②另取20.0ml该溶液,加入足量的AgNO3溶液,生成白色沉淀11.48g由此可得出关于原溶液组成的正确结论是( )
| A、一定含Mg2+、Al3+、Cl-,不含Na+、NH4+ |
| B、一定含Na+、Mg2+、Cl-,不含NH4+,可能含有Al3+ |
| C、c(Cl-)为4.0mol/L,c(Al3+)为1.0mol/L |
| D、c(Mg2+)为1.0mol/L,c(Na+)为0.5mol/L |
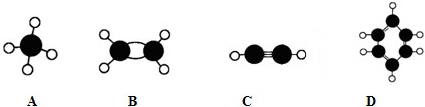
下列对三种有机物的叙述不正确的是( )
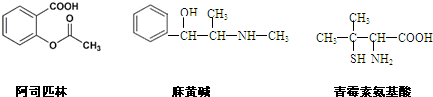

| A、三种有机物都能发生酯化反应 |
| B、阿司匹林能与NaOH溶液反应生成可溶性有机物 |
| C、麻黄碱的分子式是C10H15NO,苯环上的一氯代物有3种 |
| D、青霉素氨基酸不能与盐酸反应,但能与NaOH溶液反应 |