题目内容
4.已知硫酸在水中的电离方程式是:H2SO4═H++HSO4-,HSO4-?H++SO42-,回答下列问题:(1)Na2SO4溶液显碱性(填“酸性”,“中性”或“碱性”).理由是SO42-+H2O?OH-+HSO4-(用离子方程式表示).
(2)在0.1mol•L-1的Na2SO4溶液中,下列微粒浓度关系正确的有BCD.
A.c(SO42-)+c(HSO4-)+c(H2SO4)=0.1mol•L-1
B.c(OH-)=c(H+)+c(HSO4-)
C.c(Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-)
D.c(Na+)=2c(SO42-)+2c(HSO4-)
(3)如果25℃时,0.1mol•L-1的NaHSO4溶液中c(SO42-)=0.029mol•L-1,则0.1mol•L-1H2SO4溶液中c(SO42-)< 0.029mol•L-1(填“<”,“>”或“=”),理由是H2SO4第一步电离产生的H+,抑制了HSO4-的电离.
(4)0.1mol•L-1NaHSO4溶液中各种离子浓度由大到小的顺序是:c(Na+)>c(HSO4-)>c(H+)>c(SO42-)>c(OH-).
(5)如果25℃时,0.10mol•L-1H2SO4溶液的pH=-lg 0.11,则25℃时,0.10mol•L-1的H2SO4溶液中c(SO42-)=0.01mol/L.
分析 (1)硫酸在水溶液中存在两步电离,第一步完全电离、第二步部分电离,所以硫酸根离子能水解生成硫酸氢根离子而使硫酸钠溶液呈碱性;
(2)任何电解质溶液中都存在电荷守恒、物料守恒,根据电荷守恒和物料守恒判断;
(3)依据硫酸在水中的第一步电离是完全的,第二步电离并不完全,结合平衡移动分析判断;
(4)0.1mol•L-1的NaHSO4溶液中c(SO42-)=0.029mol•L-1,则c(HSO4-)>c(SO42-),溶液显酸性;
(5)H+抑制HSO4-的电离.
解答 解:(1)根据硫酸的第一步电离是完全的:H2SO4=H++HSO4-,第二步电离并不完全:HSO4-?H++SO42-,则Na2SO4溶液存在SO42-+H2O?OH-+HSO4-,溶液呈弱碱性,
故答案为:碱性;SO42-+H2O?OH-+HSO4-;
(2)A.溶液中没有H2SO4分子,c(SO42-)+c(HSO4-)=0.1mol•L-1,故A错误;
B.溶液中存在质子守恒,即c(OH-)=c(H+)+c(HSO4-),故B正确;
C.溶液中存在电荷守恒,即阴离子的负电荷总数等于正电荷总数,则c(Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-),故C正确;
D.c(Na)=2c(S),根据S在溶液中存在形式可知:c(Na+)=2c(SO42-)+2c(HSO4-),故D正确;
故答案为:BCD;
(3)25℃时,0.10mol•L-1的NaHSO4溶液中c( SO42-)=0.029mol•L-1,则0.10mol•L-1的H2SO4溶液中氢离子浓度比硫酸氢钠溶液中大,对硫酸氢根离子电离平衡起到抑制作用,c( SO42-)<0.029mol•L-1;
故答案为:<;H2SO4第一步电离产生的H+,抑制了HSO4-的电离;
(4)0.1mol•L-1的NaHSO4溶液中c(SO42-)=0.029mol•L-1,则c(HSO4-)>c(SO42-),溶液显酸性,所以溶液中离子浓度大小关系为:c(Na+)>c(HSO4-)>c(H+)>c(SO42-)>c(OH-);
故答案为:c(Na+)>c(HSO4-)>c(H+)>c(SO42-)>c(OH-);
(5)若25℃时,0.10mol•L-1H2SO4溶液的pH=-lg0.11,C(H+)=0.11mol/L;依据:①H2SO4=H++HSO4-,②HSO4-?H++S042-.①电离出的氢离子浓度为0.10mol/L;所以②电离出的氢离子浓度为0.11mol/L-0.1.mol/L=0.01mol/L;则0.10mol•L-1的H2SO4溶液中c(SO42-)=0.01mol/L;
故答案为:0.01mol/L.
点评 本题考查离子浓度大小比较,为高频考点,侧重考查学生分析判断能力,明确硫酸两步电离特点是解本题关键,注意硫酸氢根离子只能发生电离不能发生水解反应,为易错点.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案| A. | SO2和O2 | B. | H2和HCl | C. | H2S和HCl | D. | Cl2和HCl |
| A. | 该原电池的正极是锌 | B. | 铜电极发生还原反应 | ||
| C. | 原电池中Cu2+向锌极移动 | D. | 铜极有气体放出 |
反应Ⅰ:CH3CHO+I2→CH3I2+HI+CO
反应Ⅱ:CH3I+HI→CH4+I2 .
| A. | 反应速率与I2的浓度有关 | |
| B. | HI在反应Ⅰ中是氧化产物 | |
| C. | 反应焓变的绝对值等于190kJ•mol-1 | |
| D. | 乙醛的反应速率主要取决于反应Ⅱ |

下列说法正确的是( )
| A. | V=896 | B. | 滤液A中的阳离子为Fe2+、Fe3+、H+ | ||
| C. | 样品中CuO的质量为4.0g | D. | 样品中Fe元素的质量为2.24g |
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
| A. | 在水中通入氯气:Cl2+H2O=Cl-+2H++ClO- | |
| B. | 二氧化硅与烧碱溶液反应:SiO2+2OH-=SiO32-+H2O | |
| C. | 往氯化铝溶液中滴加过量的氨水:Al3++4NH3•H2O=[Al(OH)4]-+4NH4+ | |
| D. | 往氯化铁溶液中加入铜:Fe3++Cu=Cu2++Fe2+ |
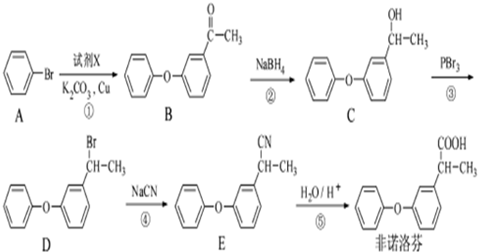
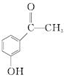 .
.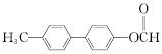 .
. 为原料制备
为原料制备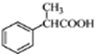 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: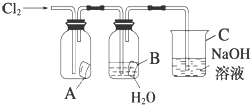 某同学按图进行实验,在A中放的是干燥的红色纸条,B中放的是湿润的红色纸条,C中盛放的是氢氧化钠溶液.请回答下列问题.
某同学按图进行实验,在A中放的是干燥的红色纸条,B中放的是湿润的红色纸条,C中盛放的是氢氧化钠溶液.请回答下列问题.