题目内容
17.下列有关化学用语表示正确的是( )| A. | 次氯酸的电子式: | B. | CO2的结构式为:O=C=O | ||
| C. | S2-的结构示意图: | D. | NH4I的电子式: |
分析 A.次氯酸的中心原子为O原子,不存在H-Cl键;
B.二氧化碳分子中含有两个碳氧双键;
C.硫离子的核外电子总数为18,最外层满足8电子稳定结构;
D.碘离子为阴离子,需要标出最外层电子.
解答 解:A.次氯酸为共价化合物,H原子最外层1个电子,Cl原子最外层7个电子,O原子最外层6个电子,则其电子式为 ,故A错误;
,故A错误;
B.CO2分子中含有两个碳氧双键,为直线型结构,其结构式为:O=C=O,故B正确;
C. 为硫原子结构示意图,硫离子的最外层达到8电子稳定结构,其正确的离子结构示意图为:
为硫原子结构示意图,硫离子的最外层达到8电子稳定结构,其正确的离子结构示意图为: ,故C错误;
,故C错误;
D.没有标出碘离子的最外层电子,NH4I的电子式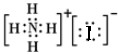 ,故D错误;
,故D错误;
故选B.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、离子结构示意图、结构式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案
相关题目
7.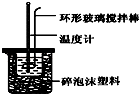 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:完成下列问题:
实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:完成下列问题:
(1)实验时不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是Cu传热快,热量损失大.
(2)在操作正确的前提下,提高中和热测定准确性的关键是提高装置的保温效果.
(3)根据上表中所测数据进行计算,则该实验测得的中和热△H=-56.8kJ/mol[盐酸和NaOH溶液的密度按1g•cm-3计算,反应后混合溶液的比热容(c)按4.18J•(g•℃)-1计算].如改用0.6mol/L的盐酸进行实验,其他情况不变,则实验中测得的“中和热”数值将不变(填“偏大”、“偏小”、“不变”).其理由是放出的热量多,生成的水也多,但中和热不变.
(4)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是ABDF.
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较低
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F.大烧杯的盖板中间小孔太大.
 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:完成下列问题:
实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:完成下列问题:| 实验次数 | 起始温度t1/℃ | 起始温度t1/℃ | 终止温度t2/℃ |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
(2)在操作正确的前提下,提高中和热测定准确性的关键是提高装置的保温效果.
(3)根据上表中所测数据进行计算,则该实验测得的中和热△H=-56.8kJ/mol[盐酸和NaOH溶液的密度按1g•cm-3计算,反应后混合溶液的比热容(c)按4.18J•(g•℃)-1计算].如改用0.6mol/L的盐酸进行实验,其他情况不变,则实验中测得的“中和热”数值将不变(填“偏大”、“偏小”、“不变”).其理由是放出的热量多,生成的水也多,但中和热不变.
(4)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是ABDF.
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较低
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F.大烧杯的盖板中间小孔太大.
5.下列关于化学键的说法中不正确的是( )
| A. | 化学键可以使离子相结合,也可以使原子相结合 | |
| B. | 非金属元素的原子之间只能形成共价键 | |
| C. | 化学反应过程中,反应物分子内的化学键断裂,产物分子中化学键形成 | |
| D. | 化学键是一种作用力 |
12.下列微粒半径的大小顺序不正确的是( )
| A. | S>O>F | B. | S2->Cl->K+>Ca2+ | C. | F->O2->Na+>Mg2+ | D. | Fe>Fe2+>Fe3+ |
9.下列叙述正确的是( )
| A. | 向无水乙醇中加入浓H2SO4,加热至170℃,将产生的气体通入酸性KMnO4溶液中紫红色褪去,使溶液褪色的气体一定是乙烯 | |
| B. | 苯酚钠溶液中通入少量二氧化碳得到苯酚和碳酸钠溶液 | |
| C. | 正丁烷的所有碳原子都在同一条直线上 | |
| D. | 实验室可用电石与饱和食盐水反应制取乙炔气体 |
6.X、Y、Z三种短周期元素,X原子的最外层电子数是次外层电子数的2倍,Y原子的次外层电子数是最外层电子数的2倍,Z原子的次外层电子数是最外层电子数的4倍.则X、Y、Z三种元素,可能的组合是( )
| A. | C、Mg、Li | B. | Li、C、Mg | C. | C、Si、Mg | D. | C、O、Mg |
7.下列各组分子中,都属于含极性键的非极性分子的是( )
| A. | CO2、H2O2 | B. | C2H4、CH4 | C. | C60、C2H4 | D. | NH3、HCl |

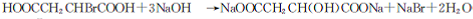 .
. +(n-1)H2O→n HOOCCH2CH(OH)COOH.
+(n-1)H2O→n HOOCCH2CH(OH)COOH.