题目内容
7.下列各组分子中,都属于含极性键的非极性分子的是( )| A. | CO2、H2O2 | B. | C2H4、CH4 | C. | C60、C2H4 | D. | NH3、HCl |
分析 非极性键为:同种元素的原子间形成的共价键;极性键为:不同元素的原子间形成的共价键;极性分子为:正电荷中心和负电荷中心不相重合的分子;非极性分子:正电荷中心和负电荷中心相重合的分子;分子极性的判断方法为:分子的极性由共价键的极性及分子的空间构型两个方面共同决定,
A.双氧水为极性键、非极性键形成的极性分子;
B.C2H4中含有极性键和非极性键,是平面型分子,结构对称,分子中正负电荷重心重叠,为非极性分子;CH4中含有极性键,为正四面体结构,结构对称,分子中正负电荷重心重叠,为非极性分子;
C.C60分子中只含有非极性键;
D.氨气和氯化氢都是由极性键形成的分子,二者正电荷中心和负电荷中心不相重合,属于极性分子.
解答 解:A.CO2为极性键形成的非极性分子,而H2O2为极性键和非金属性形成的极性分子,故A错误;
B.C2H4中含有极性键和非极性键,是平面型分子,结构对称,分子中正负电荷重心重叠,为非极性分子,CH4 中含有极性键,为正四面体结构,结构对称,分子中正负电荷重心重叠,为非极性分子,故B正确;
C.C2H4为极性键和非极性键形成的非极性分子,而C60中只含有非极性键,故C错误;
D.NH3、HCl都是由极性键形成的分子,二者正电荷中心和负电荷中心不相重合,都属于极性分子,故D错误;
故选B.
点评 本题考查了键的极性和分子的极性判断,题目难度不大,明确极性键、非极性键、极性分子与非极性分子的概念为解答关键,试题侧重考查学生的灵活应用基础知识的能力.

练习册系列答案
相关题目
17.下列有关化学用语表示正确的是( )
| A. | 次氯酸的电子式: | B. | CO2的结构式为:O=C=O | ||
| C. | S2-的结构示意图: | D. | NH4I的电子式: |
18.已知合成氨反应的浓度数据如下,当用氨气浓度的增加来表示该化学反应速率时,其速率为( )
| N2+3H2?2NH3 | |||
| 起始浓度mol/L | 1.0 | 3.0 | 0 |
| 2秒末浓度mol/L | 0.6 | 1.8 | a |
| A. | 0.2mol/(L•s) | B. | 0.4mol/(L•s) | C. | 0.6mol/(L•s) | D. | 0.8mol/(L•s) |
2.下列有关物质性质、结构的表述均正确,且存在因果关系的是( )
| 表述Ⅰ | 表述Ⅱ | |
| A | 在水中,NaCl的溶解度比I2的溶解度大 | NaCl晶体中C1-与Na+间的作用力大于碘晶体中分子间的作用力 |
| B | 通常条件下,CH4分子比PbH4分子稳定性高 | Pb的原子半径比C的大,Pb与H之间的键能比C与H间的小 |
| C | 在形成化合物时,同一主族元素的化合价相同 | 同一主族元素原子的最外层电子数相同 |
| D | P4O10、C2H6O溶于水后均不导电 | P4O10、C2H6O均属于共价化合物 |
| A. | A | B. | B | C. | C | D. | D |
12.以下有关元素性质的说法不正确的是( )
| A. | 具有下列电子排布式的原子中,①1s22s22p63s23p2②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4 原子半径最大的是① | |
| B. | 具有下列价电子排布式的原子中,①3s23p1 ②3s23p2 ③3s23p3 ④3s23p4,第一电离能最大的是③ | |
| C. | ①Na、K、Rb ②O、S、Se ③Na、P、Cl,元素的电负性随原子序数增大而递增的是③ | |
| D. | 某元素气态基态原子的逐级电离能分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X3+ |
17.人类将在未来几十年内逐渐由“碳素燃料文明时代”过渡至“太阳能文明时代”(包括风能、生物质能等太阳能的转换形态),届时人们将适应“低碳经济”和“低碳生活”.下列说法不正确的是 )
| A. | 煤、石油和天然气都属于碳素燃料 | |
| B. | 发展太阳能经济有助于减缓温室效应 | |
| C. | 太阳能电池可将太阳能转化为电能 | |
| D. | 太阳能发电过程中具有重要作用的半导体材料是二氧化硅 |
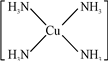 2+.
2+.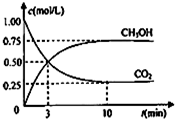 甲醇(CH3OH)是一种优质燃料,
甲醇(CH3OH)是一种优质燃料, 负极电极反应为:3H2-6e-=6H+(氧化反应);若不能,请说明原因:空
负极电极反应为:3H2-6e-=6H+(氧化反应);若不能,请说明原因:空
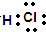 ;
;