题目内容
6.X、Y、Z三种短周期元素,X原子的最外层电子数是次外层电子数的2倍,Y原子的次外层电子数是最外层电子数的2倍,Z原子的次外层电子数是最外层电子数的4倍.则X、Y、Z三种元素,可能的组合是( )| A. | C、Mg、Li | B. | Li、C、Mg | C. | C、Si、Mg | D. | C、O、Mg |
分析 X、Y、Z三种短周期元素,X原子的最外层电子数是次外层电子数的2倍,X应有2个电子层,最外层电子数为4,则X为C;Y原子的次外层电子数是最外层电子数的2倍,则Y若有2个电子层,为Li,若Y有3个电子层,最外层电子数为4,则Y为Si;Z原子的次外层电子数是最外层电子数的4倍,Z只能为第三周期元素,Z的最外层电子数为2,则Z为Mg,以此来解答.
解答 解:X、Y、Z三种短周期元素,X原子的最外层电子数是次外层电子数的2倍,X应有2个电子层,最外层电子数为4,则X为C;Y原子的次外层电子数是最外层电子数的2倍,则Y若有2个电子层,为Li,若Y有3个电子层,最外层电子数为4,则Y为Si;Z原子的次外层电子数是最外层电子数的4倍,Z只能为第三周期元素,Z的最外层电子数为2,则Z为Mg,
综上所述,X、Y、Z三种元素,可能为C、Li、Mg或C、Si、Mg,
故选C.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构推断元素为解答的关键,侧重分析与应用能力的考查,注意均为短周期元素,题目难度不大.

练习册系列答案
相关题目
17.下列有关化学用语表示正确的是( )
| A. | 次氯酸的电子式: | B. | CO2的结构式为:O=C=O | ||
| C. | S2-的结构示意图: | D. | NH4I的电子式: |
14.醛可发生分子间的反应,生成羟基醛,如:

现在用甲醛和乙醛来制备季戊四醇[C(CH2OH)4],消耗的甲醛与乙醛的物质的量之比为( )

现在用甲醛和乙醛来制备季戊四醇[C(CH2OH)4],消耗的甲醛与乙醛的物质的量之比为( )
| A. | 3:1 | B. | 2:1 | C. | 4:1 | D. | 1:1 |
1.H2O2是常用的漂白剂和氧化剂,在环境保护、医药、化学合成等方面有重要的作用.
Ⅰ.为探究影响H2O2分解速率的因素,某实验小组进行了如下实验:
实验1:在相同的条件下,向一支试管中加入2mL5%H2O2和1mLH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象.
实验2:
将质量相同但状态不同的MnO2分别加入盛有15mL5%的H2O2溶液的大试管中,并用带火星的木条测试,实验结果如下:
回答下列问题:
(1)H2O2的分解反应是放热反应(填放热或吸热).
(2)实验1的目的是研究FeCl3对H2O2分解反应速率的影响,加入1mLH2O的作用是保持两支试管中H2O2的浓度相等.
(3)实验2的实验结果表明,催化剂的催化效果与催化剂接触面积有关.
(4)实验室检验Fe3+的实验方法是取少量的FeCl3溶液于试管中,加入几滴KSCN溶液,溶液显血红色.
Ⅱ.一条件下,H2O2在水溶液中发生复分解反应的过程中,实验测得不同时间H2O2的物质的量浓度如下表:
(1)该分解反应0~40min的平均反应速率v(H2O2)为0.015mol•L-1•min-1.
(2)如果反应所用的H2O2溶液为200mL,则0~80min共产生O22.4g.(写出计算过程)
Ⅰ.为探究影响H2O2分解速率的因素,某实验小组进行了如下实验:
实验1:在相同的条件下,向一支试管中加入2mL5%H2O2和1mLH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象.
实验2:
将质量相同但状态不同的MnO2分别加入盛有15mL5%的H2O2溶液的大试管中,并用带火星的木条测试,实验结果如下:
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(1)H2O2的分解反应是放热反应(填放热或吸热).
(2)实验1的目的是研究FeCl3对H2O2分解反应速率的影响,加入1mLH2O的作用是保持两支试管中H2O2的浓度相等.
(3)实验2的实验结果表明,催化剂的催化效果与催化剂接触面积有关.
(4)实验室检验Fe3+的实验方法是取少量的FeCl3溶液于试管中,加入几滴KSCN溶液,溶液显血红色.
Ⅱ.一条件下,H2O2在水溶液中发生复分解反应的过程中,实验测得不同时间H2O2的物质的量浓度如下表:
| t/min | 0 | 20 | 40 | 60 | 80 |
| C(H2O2)/mol•L-1 | 0.80 | 0.40 | 0.20 | 0.10 | 0.05 |
(2)如果反应所用的H2O2溶液为200mL,则0~80min共产生O22.4g.(写出计算过程)
18.已知合成氨反应的浓度数据如下,当用氨气浓度的增加来表示该化学反应速率时,其速率为( )
| N2+3H2?2NH3 | |||
| 起始浓度mol/L | 1.0 | 3.0 | 0 |
| 2秒末浓度mol/L | 0.6 | 1.8 | a |
| A. | 0.2mol/(L•s) | B. | 0.4mol/(L•s) | C. | 0.6mol/(L•s) | D. | 0.8mol/(L•s) |
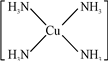 2+.
2+.
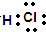 ;
;