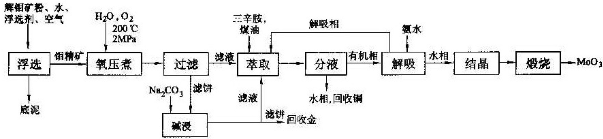
题目内容
9.下列叙述正确的是( )| A. | 向无水乙醇中加入浓H2SO4,加热至170℃,将产生的气体通入酸性KMnO4溶液中紫红色褪去,使溶液褪色的气体一定是乙烯 | |
| B. | 苯酚钠溶液中通入少量二氧化碳得到苯酚和碳酸钠溶液 | |
| C. | 正丁烷的所有碳原子都在同一条直线上 | |
| D. | 实验室可用电石与饱和食盐水反应制取乙炔气体 |
分析 A.无水乙醇中加入浓H2SO4,加热至170℃,发生消去反应生成乙烯,但乙醇易挥发,乙醇、乙烯均能被高锰酸钾氧化;
B.苯酚钠与二氧化碳反应生成苯酚和碳酸氢钠;
C.正丁烷中的C均为四面体构型;
D.电石与饱和食盐水中的水反应生成氢氧化钙和乙炔.
解答 解:A.无水乙醇中加入浓H2SO4,加热至170℃,发生消去反应生成乙烯,但乙醇易挥发,乙醇、乙烯均能被高锰酸钾氧化,则产生的气体通入酸性KMnO4溶液中紫红色褪去,不能说明一定是乙烯,应除去乙醇后检验或直接用溴水检验,故A错误;
B.苯酚钠与二氧化碳反应生成苯酚和碳酸氢钠,苯酚与碳酸钠反应,故B错误;
C.正丁烷中的C均为四面体构型,则只有2个C共直线,3个C共面,故C错误;
D.电石与水反应生成氢氧化钙和乙炔,则实验室可用电石与饱和食盐水反应制取乙炔气体,减缓反应速率,故D正确;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力考查,注意有机物的性质及有机反应、有机物检验等,综合性较强,题目难度不大.

练习册系列答案
相关题目
17.下列有关化学用语表示正确的是( )
| A. | 次氯酸的电子式: | B. | CO2的结构式为:O=C=O | ||
| C. | S2-的结构示意图: | D. | NH4I的电子式: |
4.短周期元素A、B、C、D、E的原子序数依次增大,A的一中同位素的质量数为1,A和B同主族,C原子的最外层电子数是电子层数的3倍,D的最高正价与最低负价的绝对值相等,E的最高价氧化物的水化物的化学式为HnEO2n+2.下列说法正确的是( )
| A. | A与D可形成含18e-的离子化合物 | |
| B. | B单质在C单质中燃烧生成原子个数比为1:1的化合物 | |
| C. | D的氧化物为酸性氧化物,溶于水可制得D的含氧酸 | |
| D. | D与E组成的化合物中,各原子最外层均达到8电子结构 |
14.醛可发生分子间的反应,生成羟基醛,如:

现在用甲醛和乙醛来制备季戊四醇[C(CH2OH)4],消耗的甲醛与乙醛的物质的量之比为( )

现在用甲醛和乙醛来制备季戊四醇[C(CH2OH)4],消耗的甲醛与乙醛的物质的量之比为( )
| A. | 3:1 | B. | 2:1 | C. | 4:1 | D. | 1:1 |
1.H2O2是常用的漂白剂和氧化剂,在环境保护、医药、化学合成等方面有重要的作用.
Ⅰ.为探究影响H2O2分解速率的因素,某实验小组进行了如下实验:
实验1:在相同的条件下,向一支试管中加入2mL5%H2O2和1mLH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象.
实验2:
将质量相同但状态不同的MnO2分别加入盛有15mL5%的H2O2溶液的大试管中,并用带火星的木条测试,实验结果如下:
回答下列问题:
(1)H2O2的分解反应是放热反应(填放热或吸热).
(2)实验1的目的是研究FeCl3对H2O2分解反应速率的影响,加入1mLH2O的作用是保持两支试管中H2O2的浓度相等.
(3)实验2的实验结果表明,催化剂的催化效果与催化剂接触面积有关.
(4)实验室检验Fe3+的实验方法是取少量的FeCl3溶液于试管中,加入几滴KSCN溶液,溶液显血红色.
Ⅱ.一条件下,H2O2在水溶液中发生复分解反应的过程中,实验测得不同时间H2O2的物质的量浓度如下表:
(1)该分解反应0~40min的平均反应速率v(H2O2)为0.015mol•L-1•min-1.
(2)如果反应所用的H2O2溶液为200mL,则0~80min共产生O22.4g.(写出计算过程)
Ⅰ.为探究影响H2O2分解速率的因素,某实验小组进行了如下实验:
实验1:在相同的条件下,向一支试管中加入2mL5%H2O2和1mLH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象.
实验2:
将质量相同但状态不同的MnO2分别加入盛有15mL5%的H2O2溶液的大试管中,并用带火星的木条测试,实验结果如下:
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(1)H2O2的分解反应是放热反应(填放热或吸热).
(2)实验1的目的是研究FeCl3对H2O2分解反应速率的影响,加入1mLH2O的作用是保持两支试管中H2O2的浓度相等.
(3)实验2的实验结果表明,催化剂的催化效果与催化剂接触面积有关.
(4)实验室检验Fe3+的实验方法是取少量的FeCl3溶液于试管中,加入几滴KSCN溶液,溶液显血红色.
Ⅱ.一条件下,H2O2在水溶液中发生复分解反应的过程中,实验测得不同时间H2O2的物质的量浓度如下表:
| t/min | 0 | 20 | 40 | 60 | 80 |
| C(H2O2)/mol•L-1 | 0.80 | 0.40 | 0.20 | 0.10 | 0.05 |
(2)如果反应所用的H2O2溶液为200mL,则0~80min共产生O22.4g.(写出计算过程)
18.已知合成氨反应的浓度数据如下,当用氨气浓度的增加来表示该化学反应速率时,其速率为( )
| N2+3H2?2NH3 | |||
| 起始浓度mol/L | 1.0 | 3.0 | 0 |
| 2秒末浓度mol/L | 0.6 | 1.8 | a |
| A. | 0.2mol/(L•s) | B. | 0.4mol/(L•s) | C. | 0.6mol/(L•s) | D. | 0.8mol/(L•s) |
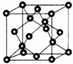 AIN是重要的半导体材料,Ga(镓)、P、As都是形成化合物半导体材料的重要元素.
AIN是重要的半导体材料,Ga(镓)、P、As都是形成化合物半导体材料的重要元素.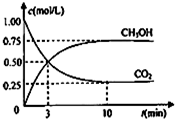 甲醇(CH3OH)是一种优质燃料,
甲醇(CH3OH)是一种优质燃料, 负极电极反应为:3H2-6e-=6H+(氧化反应);若不能,请说明原因:空
负极电极反应为:3H2-6e-=6H+(氧化反应);若不能,请说明原因:空