题目内容
8.有机物H是一种可降解的聚酯类高分子材料,在材料的生物相容性方面有很好的应用前景.H的一种合成路线如下:
已知:
①有机物G发生脱水反应的产物能使溴水褪色
②1molG能与3molNa反应
③1molG能与2molNaHCO3反应并产生CO2气体
回答下列问题:
(1)D中含有的官能团的名称为醛基、溴原子,G的结构简式为HOOCCH2CH(OH)COOH.
(2)i的反应类型为加成反应,ii的反应类型为氧化反应.
(3)由A生成B的反应试剂和条件是氢氧化钠水溶、加热.
(4)与G具有相同官能团的同分异构体共有2种(不含立体异构),其中核磁共振氢谱显示为3组峰,且峰面积比为3:2:1的是HOOCC(OH)(CH3)COOH(写结构简式).
(5)由E生成F的化学方程式为
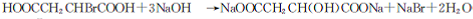 .
.(6)H为G的聚合物,H在生物体内发生水解反应的化学方程式为
 +(n-1)H2O→n HOOCCH2CH(OH)COOH.
+(n-1)H2O→n HOOCCH2CH(OH)COOH.
分析 G的分子式为C4H6O5,l molG与与2mol的NaHCO3溶液反应并产生CO2气体,而G中含有2个-COOH,1molG能与3molNa反应生成无色气体,说明G中还含有1个-OH,G发生脱水反应能产生使溴水褪色的产物,则G的结构简式为:HOOCCH2CH(OH)COOH,H是一种高分子化合物,则G发生缩聚反应得到H,H的结构简式为: .D被氧化生成E,则E中含有溴原子,E和氢氧化钠的水溶液发生水解反应生成F,F酸化生成G,所以F的结构简式为:NaOOCCH2CH(OH)COONa,E的结构简式为:HOOCCH2CHBrCOOH,D能发生银镜反应则D中含有醛基,所以D的结构简式为:OHCCH2CHBrCHO,根据1,3-丁二烯及D的结构简式知,1,3-丁二烯和溴发生1,4-加成生成A为BrCH2CH=CHCH2Br,A和氢氧化钠的水溶液发生取代反应生成B为HOCH2CH=CHCH2OH,B与HBr发生加成反应生成C,C的结构简式为:HOCH2CH2CHBrCH2OH,C再被氧化生成D,据此解答.
.D被氧化生成E,则E中含有溴原子,E和氢氧化钠的水溶液发生水解反应生成F,F酸化生成G,所以F的结构简式为:NaOOCCH2CH(OH)COONa,E的结构简式为:HOOCCH2CHBrCOOH,D能发生银镜反应则D中含有醛基,所以D的结构简式为:OHCCH2CHBrCHO,根据1,3-丁二烯及D的结构简式知,1,3-丁二烯和溴发生1,4-加成生成A为BrCH2CH=CHCH2Br,A和氢氧化钠的水溶液发生取代反应生成B为HOCH2CH=CHCH2OH,B与HBr发生加成反应生成C,C的结构简式为:HOCH2CH2CHBrCH2OH,C再被氧化生成D,据此解答.
解答 解:G的分子式为C4H6O5,l molG与与2mol的NaHCO3溶液反应并产生CO2气体,而G中含有2个-COOH,1molG能与3molNa反应生成无色气体,说明G中还含有1个-OH,G发生脱水反应能产生使溴水褪色的产物,则G的结构简式为:HOOCCH2CH(OH)COOH.H是一种高分子化合物,则G发生缩聚反应得到H,H的结构简式为: .D被氧化生成E,则E中含有溴原子,E和氢氧化钠的水溶液发生水解反应生成F,F酸化生成G,所以F的结构简式为:NaOOCCH2CH(OH)COONa,E的结构简式为:HOOCCH2CHBrCOOH,D能发生银镜反应则D中含有醛基,所以D的结构简式为:OHCCH2CHBrCHO,根据1,3-丁二烯及D的结构简式知,1,3-丁二烯和溴发生1,4-加成生成A为BrCH2CH=CHCH2Br,A和氢氧化钠的水溶液发生取代反应生成B为HOCH2CH=CHCH2OH,B与HBr发生加成反应生成C,C的结构简式为:HOCH2CH2CHBrCH2OH,C再被氧化生成D.
.D被氧化生成E,则E中含有溴原子,E和氢氧化钠的水溶液发生水解反应生成F,F酸化生成G,所以F的结构简式为:NaOOCCH2CH(OH)COONa,E的结构简式为:HOOCCH2CHBrCOOH,D能发生银镜反应则D中含有醛基,所以D的结构简式为:OHCCH2CHBrCHO,根据1,3-丁二烯及D的结构简式知,1,3-丁二烯和溴发生1,4-加成生成A为BrCH2CH=CHCH2Br,A和氢氧化钠的水溶液发生取代反应生成B为HOCH2CH=CHCH2OH,B与HBr发生加成反应生成C,C的结构简式为:HOCH2CH2CHBrCH2OH,C再被氧化生成D.
(1)由上述分析可知,D为OHCCH2CHBrCHO,含有官能团有:醛基、溴原子,G的结构简式为 HOOCCH2CH(OH)COOH,
故答案为:醛基、溴原子;HOOCCH2CH(OH)COOH;
(2)由上述分析可知,i的反应类型为加成反应,ii的反应类型为 氧化反应,
故答案为:加成反应;氧化反应;
(3)A和氢氧化钠的水溶液发生取代反应生成B,由A生成B的反应试剂和条件是氢氧化钠水溶、加热,
故答案为:氢氧化钠水溶、加热;
(4)G的结构简式为:HOOCCH2CH(OH)COOH,与G具有相同官能团的同分异构体有HOOCCH(CH2OH)COOH、HOOCC(OH)(CH3)COOH,共2种,其中在PMR中有三个吸信号,其强度之比为3:2:1的结构简式为HOOCC(OH)(CH3)COOH,
故答案为:2;HOOCC(OH)(CH3)COOH;
(5)由E生成F的化学方程式为 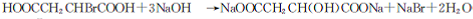 ,
,
故答案为: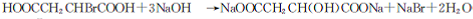 ;
;
(6)H在生物体内水解方程式为: +(n-1)H2O→n HOOCCH2CH(OH)COOH,
+(n-1)H2O→n HOOCCH2CH(OH)COOH,
故答案为: +(n-1)H2O→n HOOCCH2CH(OH)COOH.
+(n-1)H2O→n HOOCCH2CH(OH)COOH.
点评 本题考查有机物的推断与合成,确定G的结构简式解答本题的关键,再结合转化关系进行推断,需要学生熟悉掌握官能团的性质与演变,题目难度中等.

 考前必练系列答案
考前必练系列答案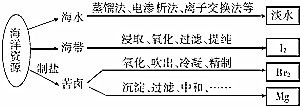
| A. | 从海水中获取淡水,历史最久的方法是离子交换法 | |
| B. | 从海带中获得I2需要用到的主要仪器有蒸发皿、漏斗、烧杯、分液漏斗等 | |
| C. | 用SO2溶液吸收从苦卤中吹出的单质溴时,发生的离子反应是Br2+SO2+2H2O═4H++SO42-+2Br- | |
| D. | 用石灰石、盐酸等从苦卤中提取镁时,发生反应的反应类型有化合、分解、置换和复分解 |
| A. | 1 mo1•L-1的 Ca(ClO)2溶液中含ClO-数目小于2NA | |
| B. | 1 mo1 N2和3 mol H2在密闭容器中充分反应后,容器中含有 N-H键数为6NA | |
| C. | 1 mol乙烯和乙醇气体的混合物完全燃烧,消耗的氧分子数为3NA | |
| D. | 标准状况下,2.24 L35Cl2中含有的中子数为3.4NA |
| A. | 次氯酸的电子式: | B. | CO2的结构式为:O=C=O | ||
| C. | S2-的结构示意图: | D. | NH4I的电子式: |
| N2+3H2?2NH3 | |||
| 起始浓度mol/L | 1.0 | 3.0 | 0 |
| 2秒末浓度mol/L | 0.6 | 1.8 | a |
| A. | 0.2mol/(L•s) | B. | 0.4mol/(L•s) | C. | 0.6mol/(L•s) | D. | 0.8mol/(L•s) |
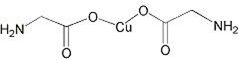 锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备: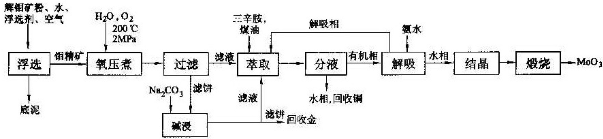
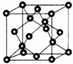 AIN是重要的半导体材料,Ga(镓)、P、As都是形成化合物半导体材料的重要元素.
AIN是重要的半导体材料,Ga(镓)、P、As都是形成化合物半导体材料的重要元素.