题目内容
12.下列微粒半径的大小顺序不正确的是( )| A. | S>O>F | B. | S2->Cl->K+>Ca2+ | C. | F->O2->Na+>Mg2+ | D. | Fe>Fe2+>Fe3+ |
分析 A.同周期自左而右原子半径减小,同主族自上而下原子半径增大;
B.电子层结构相同的离子,核电荷数越大离子半径越小;
C.电子层结构相同的离子,核电荷数越大离子半径越小;
D.阳离子半径小于相应原子半径,同种元素形成的阳离子,离子电荷越高离子半径越小.
解答 解:A.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故离子半径:S>O>F,故A正确;
B.电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:S2->Cl->K+>Ca2+,故B正确;
C.电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:O2->F->Na+>Mg2+,故C错误;
D.阳离子半径小于相应原子半径,同种元素形成的阳离子,离子电荷越高离子半径越小,故微粒半径:Fe>Fe2+>Fe3+,故D正确.
故选:C.
点评 本题考查微粒半径比较,核电荷数、电子层数、核外电子数等会影响微粒半径,注意理解微粒半径比较规律.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.青蒿素是烃的含氧衍生物,为无色针状晶体.易溶于丙酮、氯仿和苯中,在水中几乎不溶,熔点为156-157℃.青蒿素是有效的抗疟药.从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法.
乙醚浸取法的主要工艺为:

请回答下列问题:
(1)对青蒿进行干燥破碎的目的是增大青蒿与乙醚的接触面积,提高青蒿素的浸取率.
(2)操作I的名称是过滤,操作II的名称是蒸馏.
(3)用下列实验装置测定青蒿素的分子式,将28.2g青蒿素放在硬质玻璃管C中充分燃烧:

①装置E中盛放的物质是无水CaCl2或P2O5,装置F中盛放的物质是碱石灰.
②该实验装置可能产生误差,造成测定含氧量偏低,改进方法是除去装置左侧通入的空气中的CO2和水蒸气,在装置F后加一个防止空气中的CO2和水蒸气进入F的装置.
③已知青蒿素是烃的含氧衍生物,用合理改进后的装置进行实验,称得:
青蒿素的最简式是C15H22O5.
(4)某学生对青蒿素的性质进行探究.将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与C(填字母)具有相似的性质.
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖.
乙醚浸取法的主要工艺为:

请回答下列问题:
(1)对青蒿进行干燥破碎的目的是增大青蒿与乙醚的接触面积,提高青蒿素的浸取率.
(2)操作I的名称是过滤,操作II的名称是蒸馏.
(3)用下列实验装置测定青蒿素的分子式,将28.2g青蒿素放在硬质玻璃管C中充分燃烧:

①装置E中盛放的物质是无水CaCl2或P2O5,装置F中盛放的物质是碱石灰.
②该实验装置可能产生误差,造成测定含氧量偏低,改进方法是除去装置左侧通入的空气中的CO2和水蒸气,在装置F后加一个防止空气中的CO2和水蒸气进入F的装置.
③已知青蒿素是烃的含氧衍生物,用合理改进后的装置进行实验,称得:
| 装置 | 实验前/g | 实验后/g |
| E | 22.6 | 42.4 |
| F | 80.2 | 146.2 |
(4)某学生对青蒿素的性质进行探究.将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与C(填字母)具有相似的性质.
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖.
3.利用海洋资源获得的部分物质如图所示.下列说法正确的是( )
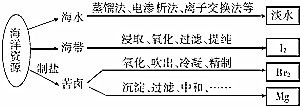

| A. | 从海水中获取淡水,历史最久的方法是离子交换法 | |
| B. | 从海带中获得I2需要用到的主要仪器有蒸发皿、漏斗、烧杯、分液漏斗等 | |
| C. | 用SO2溶液吸收从苦卤中吹出的单质溴时,发生的离子反应是Br2+SO2+2H2O═4H++SO42-+2Br- | |
| D. | 用石灰石、盐酸等从苦卤中提取镁时,发生反应的反应类型有化合、分解、置换和复分解 |
7.某元素的原子序数是34,则该基态原子中电子占据的原子轨道总数为( )
| A. | 17 | B. | 18 | C. | 19 | D. | 20 |
17.下列有关化学用语表示正确的是( )
| A. | 次氯酸的电子式: | B. | CO2的结构式为:O=C=O | ||
| C. | S2-的结构示意图: | D. | NH4I的电子式: |
4.短周期元素A、B、C、D、E的原子序数依次增大,A的一中同位素的质量数为1,A和B同主族,C原子的最外层电子数是电子层数的3倍,D的最高正价与最低负价的绝对值相等,E的最高价氧化物的水化物的化学式为HnEO2n+2.下列说法正确的是( )
| A. | A与D可形成含18e-的离子化合物 | |
| B. | B单质在C单质中燃烧生成原子个数比为1:1的化合物 | |
| C. | D的氧化物为酸性氧化物,溶于水可制得D的含氧酸 | |
| D. | D与E组成的化合物中,各原子最外层均达到8电子结构 |
1.H2O2是常用的漂白剂和氧化剂,在环境保护、医药、化学合成等方面有重要的作用.
Ⅰ.为探究影响H2O2分解速率的因素,某实验小组进行了如下实验:
实验1:在相同的条件下,向一支试管中加入2mL5%H2O2和1mLH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象.
实验2:
将质量相同但状态不同的MnO2分别加入盛有15mL5%的H2O2溶液的大试管中,并用带火星的木条测试,实验结果如下:
回答下列问题:
(1)H2O2的分解反应是放热反应(填放热或吸热).
(2)实验1的目的是研究FeCl3对H2O2分解反应速率的影响,加入1mLH2O的作用是保持两支试管中H2O2的浓度相等.
(3)实验2的实验结果表明,催化剂的催化效果与催化剂接触面积有关.
(4)实验室检验Fe3+的实验方法是取少量的FeCl3溶液于试管中,加入几滴KSCN溶液,溶液显血红色.
Ⅱ.一条件下,H2O2在水溶液中发生复分解反应的过程中,实验测得不同时间H2O2的物质的量浓度如下表:
(1)该分解反应0~40min的平均反应速率v(H2O2)为0.015mol•L-1•min-1.
(2)如果反应所用的H2O2溶液为200mL,则0~80min共产生O22.4g.(写出计算过程)
Ⅰ.为探究影响H2O2分解速率的因素,某实验小组进行了如下实验:
实验1:在相同的条件下,向一支试管中加入2mL5%H2O2和1mLH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象.
实验2:
将质量相同但状态不同的MnO2分别加入盛有15mL5%的H2O2溶液的大试管中,并用带火星的木条测试,实验结果如下:
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(1)H2O2的分解反应是放热反应(填放热或吸热).
(2)实验1的目的是研究FeCl3对H2O2分解反应速率的影响,加入1mLH2O的作用是保持两支试管中H2O2的浓度相等.
(3)实验2的实验结果表明,催化剂的催化效果与催化剂接触面积有关.
(4)实验室检验Fe3+的实验方法是取少量的FeCl3溶液于试管中,加入几滴KSCN溶液,溶液显血红色.
Ⅱ.一条件下,H2O2在水溶液中发生复分解反应的过程中,实验测得不同时间H2O2的物质的量浓度如下表:
| t/min | 0 | 20 | 40 | 60 | 80 |
| C(H2O2)/mol•L-1 | 0.80 | 0.40 | 0.20 | 0.10 | 0.05 |
(2)如果反应所用的H2O2溶液为200mL,则0~80min共产生O22.4g.(写出计算过程)
2.下列有关物质性质、结构的表述均正确,且存在因果关系的是( )
| 表述Ⅰ | 表述Ⅱ | |
| A | 在水中,NaCl的溶解度比I2的溶解度大 | NaCl晶体中C1-与Na+间的作用力大于碘晶体中分子间的作用力 |
| B | 通常条件下,CH4分子比PbH4分子稳定性高 | Pb的原子半径比C的大,Pb与H之间的键能比C与H间的小 |
| C | 在形成化合物时,同一主族元素的化合价相同 | 同一主族元素原子的最外层电子数相同 |
| D | P4O10、C2H6O溶于水后均不导电 | P4O10、C2H6O均属于共价化合物 |
| A. | A | B. | B | C. | C | D. | D |
 AIN是重要的半导体材料,Ga(镓)、P、As都是形成化合物半导体材料的重要元素.
AIN是重要的半导体材料,Ga(镓)、P、As都是形成化合物半导体材料的重要元素.