题目内容
2.下列关于物质性质的比较,不正确的是( )| A. | 酸性强弱:HIO4>HBrO4>HClO4 | B. | 原子半径大小:Al>P>N | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 金属性强弱:Na>Mg>Al |
分析 A.非金属性越强,最高价氧化物对应的水化物酸性越强;
B.根据同周期自左到右原子半径逐渐减小,同主族自上而下原子半径逐渐增大判断;
C.金属性越强,最高价氧化物对应的水化物碱性越强;
D.同周期自左到右金属性逐渐减弱.
解答 解:A.因非金属性Cl>Br>I,所以酸性强弱:HIO4<HBrO4<HClO4,故A错误;
B.同周期自左到右原子半径逐渐减小,所以原半径Al>P,同主族自上而下原子半径逐渐增大,所以原子半径P>N,故B正确;
C.因金属性K>Na>Li,所以碱性强弱:KOH>NaOH>LiOH,故C正确;
D.同周期自左到右金属性逐渐减弱,所以金属性Na>Mg>Al,故D正确;
故选A.
点评 本题考查元素周期律的递变规律,题目难度不大,学习中注意把握元素周期律,注意元素的性质与元素对应单质、化合物的性质之间的关系.

练习册系列答案
相关题目
9.工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取KMnO4,其流程示意图如下:
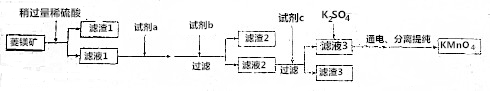
已知:①Ksp(CuS)=1.3×10-36、Ksp(MnS)=2×10-13
②金属阳离子生成氢氧化物沉淀的pH如下表:
回答下列问题:
(1)写出滤渣1的一种工业用途:建筑材料,实验室模拟流程过程中,洗涤滤渣1的具体操作方法为将沉淀放在过滤器中,水浸没沉淀自然流下,重复2~3次.
(2)试剂a最好选用B(填字母)
A.氨水 B.高锰酸钾 C.次氯酸钠 D.浓盐酸
(3)试剂b可选用CD(填选项字母)
A.氨水 B.稀硫酸 C.碳酸锰 D.Mn(OH)2 E.NaOH
(4)试剂c为MnS,析出滤液2中加入MnS后发生反应的离子方程式:MnS+Cu2+=Mn2++CuS.
(5)用惰性电极电解硫酸锰和硫酸钾混合溶液的方法可以制取高锰酸钾,写出电解时的阳极反应式:Mn2+-5e-+4H2O=8H++MnO4-.工业上用硫酸溶解碳酸锰,而不用盐酸溶解,其原因是氯离子放电生成有毒气体氯气.

已知:①Ksp(CuS)=1.3×10-36、Ksp(MnS)=2×10-13
②金属阳离子生成氢氧化物沉淀的pH如下表:
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉定时 | 8.3 | 7.6 | 2.7 | 6.7 |
| 完全沉淀时 | 9.8 | 9.6 | 3.7 | 9 |
(1)写出滤渣1的一种工业用途:建筑材料,实验室模拟流程过程中,洗涤滤渣1的具体操作方法为将沉淀放在过滤器中,水浸没沉淀自然流下,重复2~3次.
(2)试剂a最好选用B(填字母)
A.氨水 B.高锰酸钾 C.次氯酸钠 D.浓盐酸
(3)试剂b可选用CD(填选项字母)
A.氨水 B.稀硫酸 C.碳酸锰 D.Mn(OH)2 E.NaOH
(4)试剂c为MnS,析出滤液2中加入MnS后发生反应的离子方程式:MnS+Cu2+=Mn2++CuS.
(5)用惰性电极电解硫酸锰和硫酸钾混合溶液的方法可以制取高锰酸钾,写出电解时的阳极反应式:Mn2+-5e-+4H2O=8H++MnO4-.工业上用硫酸溶解碳酸锰,而不用盐酸溶解,其原因是氯离子放电生成有毒气体氯气.
10.下列说法正确的是( )
| A. | Na、Al、Fe金属单质在一定条件下与水反应都生成H2和对应的碱 | |
| B. | H2O2、Na202、SO2都具有漂白性且漂白原理相同 | |
| C. | 饱和Na2C03溶液中通入CO2溶液会变浑浊 | |
| D. | 可用石灰水吸收尾气中的S02气体 |
7.图是元素周期表的一部分,表中的①~⑩中元素,用元素符号或化学式填空回答:
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为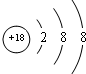
(2)地壳中含量最多的金属元素的名称是铝
(3)用电子式表示②与④形成化合物的过程 .
.
(4)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4(用化学式作答,下同),碱性最强的是KOH.
(5)写出⑤与氢氧化钠反应的化学方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑.写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式:Al (OH)3+OH-=AlO2-+2H2O.
(6)②和⑥,②和⑨形成的化合物含有的化学键类型分别是共价键,离子键.
| 族 周 期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |

(2)地壳中含量最多的金属元素的名称是铝
(3)用电子式表示②与④形成化合物的过程
 .
.(4)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4(用化学式作答,下同),碱性最强的是KOH.
(5)写出⑤与氢氧化钠反应的化学方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑.写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式:Al (OH)3+OH-=AlO2-+2H2O.
(6)②和⑥,②和⑨形成的化合物含有的化学键类型分别是共价键,离子键.
11.下列微粒中,键角最大的是( )
| A. | NH4+ | B. | H3O+ | C. | CO2 | D. | CCl4 |
12.下列条件下的反应,放出H2的速率最快的是( )
| 金属(粉末状)/mol | 酸的浓度和体积(mL) | 反应温度 | |||
| A | Mg | 0.1 | 1.5mol/L H2SO4 | 10 | 20℃ |
| B | Al | 0.1 | 3mol/L HCl | 10 | 20℃ |
| C | Zn | 0.1 | 3mol/L CH3COOH | 10 | 20℃ |
| D | Fe | 0.1 | 3mol/L HNO3 | 10 | 20℃ |
| A. | A | B. | B | C. | C | D. | D |
 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下: