题目内容
9.工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取KMnO4,其流程示意图如下: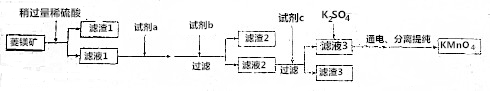
已知:①Ksp(CuS)=1.3×10-36、Ksp(MnS)=2×10-13
②金属阳离子生成氢氧化物沉淀的pH如下表:
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉定时 | 8.3 | 7.6 | 2.7 | 6.7 |
| 完全沉淀时 | 9.8 | 9.6 | 3.7 | 9 |
(1)写出滤渣1的一种工业用途:建筑材料,实验室模拟流程过程中,洗涤滤渣1的具体操作方法为将沉淀放在过滤器中,水浸没沉淀自然流下,重复2~3次.
(2)试剂a最好选用B(填字母)
A.氨水 B.高锰酸钾 C.次氯酸钠 D.浓盐酸
(3)试剂b可选用CD(填选项字母)
A.氨水 B.稀硫酸 C.碳酸锰 D.Mn(OH)2 E.NaOH
(4)试剂c为MnS,析出滤液2中加入MnS后发生反应的离子方程式:MnS+Cu2+=Mn2++CuS.
(5)用惰性电极电解硫酸锰和硫酸钾混合溶液的方法可以制取高锰酸钾,写出电解时的阳极反应式:Mn2+-5e-+4H2O=8H++MnO4-.工业上用硫酸溶解碳酸锰,而不用盐酸溶解,其原因是氯离子放电生成有毒气体氯气.
分析 菱锰矿用盐酸酸浸,MnCO3、FeCO3、Cu2(OH)2CO3与盐酸反应,SiO2不与盐酸反应,过滤得到滤渣1为SiO2,滤液1中含有氯化镁、氯化亚铁、氯化铜及剩余的HCl,向滤液中加入试剂a为高锰酸钾,将溶液中Fe2+氧化为Fe3+,加入试剂b为碳酸锰、Mn(OH)2等调节PH=4时Fe3+转化为Fe(OH)3沉淀,过滤除去,滤液2中加入试剂c为MnS,将溶液中Cu2+氧化为CuS沉淀过滤除去,滤液3中为MnCl2,最后经电解得到KMnO4.
(1)二氧化硅可用于建筑、铺路或生成硅酸盐等;将沉淀放在过滤器中,水浸没沉淀自然流下;
(2)试剂a将溶液中Fe2+氧化为Fe3+,且不能引入新杂质;
(3)试剂b调节pH使铁离子转化为沉淀,但不能引入新杂质;
(4)发生沉淀的转化;
(5)由题意可知,阳极发生氧化反应,锰离子失去电子;用氯化镁时电解氯离子放电生成氯气.
解答 解:菱锰矿用盐酸酸浸,MnCO3、FeCO3、Cu2(OH)2CO3与盐酸反应,SiO2不与盐酸反应,过滤得到滤渣1为SiO2,滤液1中含有氯化镁、氯化亚铁、氯化铜及剩余的HCl,向滤液中加入试剂a为高锰酸钾,将溶液中Fe2+氧化为Fe3+,加入试剂b为碳酸锰、Mn(OH)2等调节PH=4时Fe3+转化为Fe(OH)3沉淀,过滤除去,滤液2中加入试剂c为MnS,将溶液中Cu2+氧化为CuS沉淀过滤除去,滤液3中为MnCl2,最后经电解得到KMnO4.
(1)二氧化硅可用于建筑、铺路或生成硅酸盐等;洗涤滤渣1的具体操作方法为将沉淀放在过滤器中,水浸没沉淀自然流下,重复2~3次,
故答案为:建筑材料;将沉淀放在过滤器中,水浸没沉淀自然流下,重复2~3次;
(2)试剂a将溶液中Fe2+氧化为Fe3+,且不能引入新杂质,只有高锰酸钾符合,故答案为:B;
(3)试剂b调节pH使铁离子转化为沉淀,但不能引入新杂质,则加入试剂b为碳酸锰、Mn(OH)2等,故答案为:CD;
(4)MnS与氯化铜反应转化更难溶的CuS,同时得到氯化镁,反应离子方程式为MnS+Cu2+=Mn2++CuS,故答案为:MnS+Cu2+=Mn2++CuS;
(5)用惰性电极电解硫酸锰和硫酸钾混合溶液的方法可以制取高锰酸钾,电解时的阳极反应式为Mn2+-5e-+4H2O=8H++MnO4-.工业上用硫酸溶解碳酸锰,而不用盐酸溶解,其原因是氯离子放电生成有毒气体氯气,故答案为:Mn2+-5e-+4H2O=8H++MnO4-;氯离子放电生成有毒气体氯气.
点评 本题考查混合物分离提纯及物质制备实验,为高频考点,把握实验流程中的反应、混合物分离提纯、电解原理为解答 的关键,综合性较强,侧重分析与实验能力的考查,题目难度不大.

| A. | 加入碳酸锰的目的是除去Fe3+ | |
| B. | 常温下pH=4时,Fe3+已除尽 | |
| C. | Cu2+(aq)+MnS(s)=CuS(s)+Mn2+(aq)的K=2.73×10-23 | |
| D. | Mn2(OH)2CO3、Mn(OH)2都可以替代MnCO3 |
| A. | CH3Cl只存在一种空间结构 | |
| B. | CH2Cl2只存在一种空间结构 | |
| C. | CHCl3只存在一种空间结构 | |
| D. | CH4的四个价键的键角和键长都相等 |
| A. | RO | B. | R2Om | C. | R2Om-n | D. | R2O2m-n |
| A. | 将废电池深埋,可防止重金属污染 | |
| B. | 所有需要加热的化学反应都是吸热反应 | |
| C. | 开发利用可燃冰是缓解能源紧缺的唯一途径 | |
| D. | 开发太阳能、风能和氢能等能源代替化石燃料,有利于节约资源、保护环境 |
| A. | 酸性强弱:HIO4>HBrO4>HClO4 | B. | 原子半径大小:Al>P>N | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 金属性强弱:Na>Mg>Al |

 .
.