题目内容
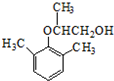
20.有机物X是合成绿原酸的重要试剂,其结构如图所示,下列有关X的说法正确的是( )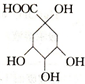
| A. | 1mol X能与5mol NaOH反应 | B. | X能发生加成、取代、氧化反应 | ||
| C. | X的分子式为C7H8O6 | D. | X与乙酸、乙醇均能发生取代反应 |
分析 由结构可知分子式,分子中含-OH、-COOH,结合醇、羧酸的性质来解答.
解答 解:A.只有-COOH与NaOH反应,则1mol X能与4mol NaOH反应,故A错误;
B.含-OH可发生取代、氧化反应,不能发生加成反应,故B错误;
C.X的分子式为C7H12O6,故C错误;
D.含-OH、-COOH均可发生取代反应,故D正确;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系等为解答的关键,侧重分析与应用能力的考查,注意醇、羧酸的性质,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.实验式相同,但既不是同系物,又不是同分异构体的是( )
| A. | 1-戊烯和2-甲基-1-丙烯 | B. | 甲醛和甲酸甲酯 | ||
| C. | 1-丁醇和甲乙醚 | D. | 丁酸和乙酸乙酯 |
10.雾霾天气肆虐给人类健康带来了严重影响.燃煤和汽车尾气是造成空气污染的原因之一.
(1)汽车尾气净化的主要原理为:2NO(g)+2CO$?_{△}^{催化剂}$2CO2(g)+N2(g)△H<0
①该反应的速率时间图象如图1中甲图所示.若其他条件不变,仅在反应前加入合适的催化剂,其速率时间图象如图1中乙图所示.以下说法正确的是BC(填对应字母).
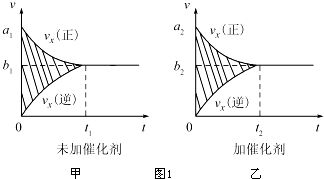
A.a1>a2 B.b1<b2 C.t1>t2
D.乙图中阴影部分面积更大
E.甲图中阴影部分面积更大
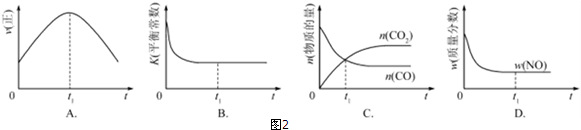
②若该反应在绝热、恒容的密闭体系中进行,图2示意图正确且能说明反应在进行到t1时刻达到平衡状态的是BD(填代号).
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
已知:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol
2NO2(g)═N2O4(g)△H=-56.9kJ/mol H2O(g)=H2O(l)△H=-44.0kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:CH4(g)+N2O4(g)=N2(g)+2H2O(l)+CO2(g)△H=-898.1kJ/mol.
(3)CH4和H2O(g) 在催化剂表面发生反应CH4+H2O?CO+3H2,该反应在不同温度下的化学平衡常数如下表.
①该反应是吸热反应(填“吸热”或“放热”).
②T℃时,向1L密闭容器中投人l mol CH4和l mol H2O(g),平衡时c(CH4)=0.5mol/L,该温度下反应CH4+H2O═CO+3H2的平衡常数K=6.75.
(4)甲烷燃料电池可以提升能量利用率.如图3是利用甲烷燃料电池电解100ml1mol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变).
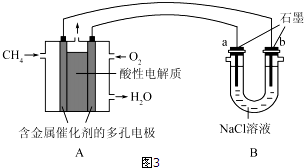
①甲烷燃料电池的负极反应式:CH4-8e-+2H2O=CO2+8H+;
②电解后溶液的pH=14(忽略氯气与氢氧化钠溶液反应)
③阳极产生气体的体积在标准状况下是1.68L.
(1)汽车尾气净化的主要原理为:2NO(g)+2CO$?_{△}^{催化剂}$2CO2(g)+N2(g)△H<0
①该反应的速率时间图象如图1中甲图所示.若其他条件不变,仅在反应前加入合适的催化剂,其速率时间图象如图1中乙图所示.以下说法正确的是BC(填对应字母).

A.a1>a2 B.b1<b2 C.t1>t2
D.乙图中阴影部分面积更大
E.甲图中阴影部分面积更大
②若该反应在绝热、恒容的密闭体系中进行,图2示意图正确且能说明反应在进行到t1时刻达到平衡状态的是BD(填代号).

(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
已知:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol
2NO2(g)═N2O4(g)△H=-56.9kJ/mol H2O(g)=H2O(l)△H=-44.0kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:CH4(g)+N2O4(g)=N2(g)+2H2O(l)+CO2(g)△H=-898.1kJ/mol.
(3)CH4和H2O(g) 在催化剂表面发生反应CH4+H2O?CO+3H2,该反应在不同温度下的化学平衡常数如下表.
| 温度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
②T℃时,向1L密闭容器中投人l mol CH4和l mol H2O(g),平衡时c(CH4)=0.5mol/L,该温度下反应CH4+H2O═CO+3H2的平衡常数K=6.75.
(4)甲烷燃料电池可以提升能量利用率.如图3是利用甲烷燃料电池电解100ml1mol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变).

①甲烷燃料电池的负极反应式:CH4-8e-+2H2O=CO2+8H+;
②电解后溶液的pH=14(忽略氯气与氢氧化钠溶液反应)
③阳极产生气体的体积在标准状况下是1.68L.



 .
.
 .
.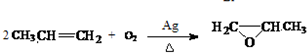 .
. .
.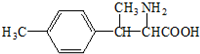 .
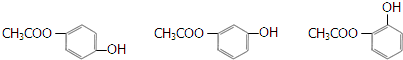
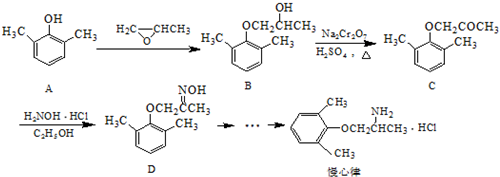
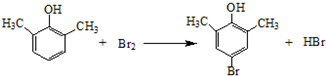
.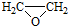 ).写出以邻甲基苯酚 (
).写出以邻甲基苯酚 (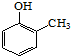 )和乙醇为原料制备
)和乙醇为原料制备 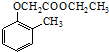 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2.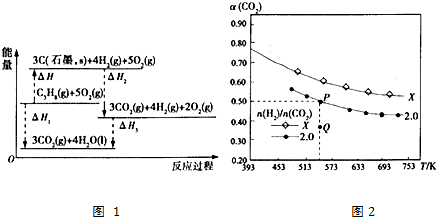
 .
. 利用2Al+2NaOH+2H2O=2NaAlO2+3H2反应,设计一个原电池.
利用2Al+2NaOH+2H2O=2NaAlO2+3H2反应,设计一个原电池.