题目内容
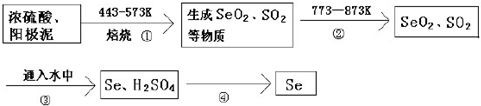
12. 利用2Al+2NaOH+2H2O=2NaAlO2+3H2反应,设计一个原电池.
利用2Al+2NaOH+2H2O=2NaAlO2+3H2反应,设计一个原电池.(1)画出装置图(在图中标出电极材料、正负极、电解质溶液).
(2)写出电极反应方程式:Al-3e-+4OH-=AlO2-+H2O,正极:2H2O+2e-=H2↑+2OH-.
分析 该反应中Al元素化合价由0价变为+3价、H元素化合价由+1价变为0价,发生氧化反应的金属Al作负极、不如Al活泼的金属或导电的非金属作正极,NaOH为电解质,据此设计原电池.
解答 解:(1)该反应中Al元素化合价由0价变为+3价、H元素化合价由+1价变为0价,发生氧化反应的金属Al作负极、不如Al活泼的金属或导电的非金属作正极,NaOH为电解质,其装置图 ,故答案为
,故答案为 ;
;
(2)由方程式可知,Al被氧化,为原电池的负极,负极反应为Al-3e-+4OH-=AlO2-+H2O,正极H2O被还原,电极方程式为2H2O+2e-=H2↑+2OH-,
故答案为:Al-3e-+4OH-=AlO2-+H2O;2H2O+2e-=H2↑+2OH-.
点评 本题考查了原电池设计,题目难度不大,正确判断原电池正负极材料、电解质溶液是设计原电池的关键,一般来说,还原剂作负极,不如负极活泼的金属或非金属导体作正极,氧化剂的溶液作电解质溶液.

练习册系列答案
相关题目
2.化学是一门以实验为基础,研究物质的组成、结构、性质及其变化规律的自然科学.学习科学研究的基本方法,可以加深对科学本质的认识,增进对物质世界的认识.下列有关叙述不正确的是( )
| A. | 将乙酸乙酯与H218O混合后,用稀硫酸作催化剂,借以判断乙酸乙酯水解时分子中共价键的断裂情况,该方法应称为同位素示踪法 | |
| B. | 相对分子质量的测定常用质谱仪,分子结构测定方法主要是用红外光谱法 | |
| C. | C6H5-OH能与浓溴水生成三溴苯酚,甲苯却不能与浓溴水反应,说明苯酚分子中由于苯环影响,使羟基上H原子变得活泼 | |
| D. | 燃烧法是研究确定有机物成分的有效方法 |
3.下列有关叙述正确的是( )
| A. | “歼-20”飞机上大量使用的碳纤维是一种新型的有机高分子材料 | |
| B. | 铝合金的大量使用是因为人们能用氢气等还原剂从氧化铝中获取铝 | |
| C. | 酸碱指示剂变色、煤的液化、海水提溴、皂化反应都涉及化学变化 | |
| D. | 金属镁着火可使用干粉灭火器灭火,但不可用泡沫灭火器灭火 |
20.有机物X是合成绿原酸的重要试剂,其结构如图所示,下列有关X的说法正确的是( )
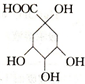

| A. | 1mol X能与5mol NaOH反应 | B. | X能发生加成、取代、氧化反应 | ||
| C. | X的分子式为C7H8O6 | D. | X与乙酸、乙醇均能发生取代反应 |
1.NA代表阿伏加德罗常数数值,下列有关叙述正确的是( )
| A. | 28g CO、C2H4混合气体的分子总数NA,体积约为22.4L | |
| B. | 9.2g金属钠投入到足量的重水中所得气体中含有0.4NA中子 | |
| C. | 25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| D. | 0.1mol/LFeCl3溶液中所含Fe3+的数目小于0.1NA |
2.下列有关说法错误的是( )
| A. | 使用热的纯碱水洗手时更容易除去手上的油脂污垢 | |
| B. | 若发现厨房内天然气发生了泄漏,应立即打开门窗 | |
| C. | 用无水硫酸铜检验酒精中含有水的过程中发生了化学变化 | |
| D. | 抗战胜利70周年阅兵式上释放的气球中充入的是氢气 |
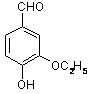 是食品添加剂的增香原料,其香味比香草醛更浓郁.
是食品添加剂的增香原料,其香味比香草醛更浓郁.
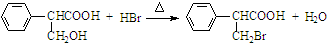 ,属于取代反应(填反应类型).
,属于取代反应(填反应类型).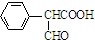 .
.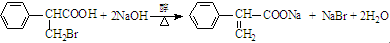 .
.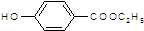 )是一种医药中间体,请设计合理方案用
)是一种医药中间体,请设计合理方案用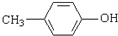 合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).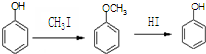
 .
.