题目内容
5.明矾石的主要成分是K2SO4•Al2(SO4)3•2Al2O3•6H2O,还含有少量Fe2O3杂质.利用明矾石制备氢氧化铝的流程如下: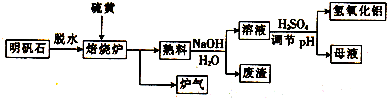
(1)焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S$\frac{\underline{\;高温\;}}{\;}$2Al2O3+9SO2,标出电子转移的方向和数目
 .
.(2)将标准状况下,1.12L炉气通入100mL 0.5mol/L NaOH溶液中,得到一种酸性溶液,则该溶液中各种离子浓度由大到小的排列顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-).
(3)熟料溶解时反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
(4)检验废渣中含有Fe2O3所需的试剂是稀HCl和KSCN溶液.
(5)母液中溶质主要成分的化学式为K2SO4和Na2SO4,溶液调节pH后经过滤、洗涤可得Al(OH)3沉淀,证明沉淀已洗涤干净的实验操作和现象是:取最后一次洗涤液于试管中,滴加BaCl2溶液,若无白色沉淀生成,证明已洗净.
分析 (1)所含元素化合价降低的反应物是氧化剂;反应中硫单质中硫元素化合价由0价升高为SO2中+4价,硫单质为还原剂,单线桥标注转移电子数目;
(2)根据n=$\frac{V}{{V}_{m}}$计算二氧化硫的物质的量,根据n(SO2):n(NaOH)确定反应产物,再结合溶液呈酸性进行判断;
(3)由工艺流程可知,熟料溶解为氧化铝与氢氧化钠溶液反应生成偏铝酸钠;
(4)废渣中加入盐酸,滴加KSCN溶液,若溶液被红色,说明废渣中含有Fe2O3;
(5)由工艺流程可知,熟料溶解所得的溶液中含有K+、Na+、SO42-、AlO2-、OH-等,加硫酸调PH值,AlO2-转化为Al(OH)3,母液中离子主要有K+、Na+、SO42-.Al(OH)3沉淀会附着K+、Na+、SO42-等,用BaCl2溶液检验最后的洗涤液中是否含有SO42-,确定是否洗涤干净.
解答 解:(1)反应中硫元素化合价由Al2(SO4)3中+6价降低为SO2中+4价,故Al2(SO4)3是氧化剂,反应中硫单质中硫元素化合价由0价升高为SO2中+4价,硫单质为还原剂,电子转移总数12,单线桥标注电子转移为 ,
,
故答案为: ;
;
(2)1.12L二氧化硫的物质的量为$\frac{1.12L}{22.4L/mol}$=0.05mol,n(NaOH)=0.1L×0.5mol/L=0.05mol,n(SO2):n(NaOH)=0.05mol:0.05mol=1:1,故反应后溶液中溶质为NaHSO3,溶液呈酸性,说明HSO3-的电离程度大于水解程度,同时水电离生成氢离子,故c(H+)>c(SO32-),HSO3-电离程度不大,故c(HSO3-)>c(H+),溶液c(OH-)等于水电离生成,浓度很小,故溶液中离子浓度由大到小的排列顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),
故答案为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);
(3)由工艺流程可知,熟料溶解为氧化铝与氢氧化钠溶液反应生成偏铝酸钠,离子方程式为Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O;
(4)废渣中加入盐酸,滴加KSCN溶液,若溶液被红色,说明废渣中含有Fe2O3,
故答案为:盐酸、KSCN溶液;
(5)由工艺流程可知,熟料溶解所得的溶液中含有K+、Na+、SO42-、AlO2-、OH-等,加硫酸调PH值,AlO2-转化为Al(OH)3,母液中离子主要有K+、Na+、SO42-,含有溶质为K2SO4、Na2SO4,
Al(OH)3沉淀会附着K+、Na+、SO42-等,取最后的洗涤液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净.
故答案为:K2SO4、Na2SO4;取最后的洗涤液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净.
点评 本题考查学生对工艺流程的理解、氧化还原反应、离子浓度大小比较、离子检验、实验方案设计等,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.(2)中注意先根据计算确定反应后溶液中溶质.

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案| A. | 水属于氧化物 | B. | 水分子中含有非极性键 | ||
| C. | 冰与可燃冰的化学成分完全相同 | D. | 氟气与水的反应中,水作氧化剂 |
| A. | Y位于元素周期表的第2周期第IVA族 | |
| B. | X、Y、Z、W、M的原子半径由大到小的顺序为M>Y>Z>W>X | |
| C. | X、Z、W形成的盐中只含有离子键 | |
| D. | 产生刺激性气味气体的反应离子方程式为H++HSO3-=H2O+SO2↑ |
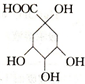
| A. | 1mol X能与5mol NaOH反应 | B. | X能发生加成、取代、氧化反应 | ||
| C. | X的分子式为C7H8O6 | D. | X与乙酸、乙醇均能发生取代反应 |
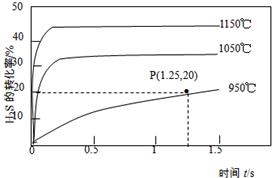 硫化氢分解制取氢气和硫磺的原理为:2H2S(s)═S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图所示.下列说法正确的是( )
硫化氢分解制取氢气和硫磺的原理为:2H2S(s)═S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图所示.下列说法正确的是( )| A. | 图中P点:v(正)<v(逆) | |
| B. | 正反应为放热反应 | |
| C. | 950℃时,0~1.25s生成H2的平均反应速率为:0.008mol•L-1•s-1 | |
| D. | 950℃时,该反应的平衡常数的值小于3.125×10-4 |
| A. | 标准状况下,11.2L的CHCl3含有的分子数为0.5NA | |
| B. | 28gSi晶体中含有Si-Si键的个数为4NA | |
| C. | 常温下,78g某浓度的乙炔的苯溶液中含碳原子数为6NA | |
| D. | 0.1 molCnH2n+2中含有的碳碳单键数为0.1nNA |
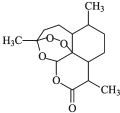 2015年,中国科学家屠呦呦因发现治疗疟疾的药物青蒿素获得了诺贝尔奖.青蒿素的结构如图所示,下列有关青蒿素的说法中正确的是( )
2015年,中国科学家屠呦呦因发现治疗疟疾的药物青蒿素获得了诺贝尔奖.青蒿素的结构如图所示,下列有关青蒿素的说法中正确的是( )| A. | 分子式为C15H20O5 | B. | 具有较强的还原性 | ||
| C. | 易溶于水,乙醇和乙醚 | D. | 氧原子的化合价由-1和-2 |
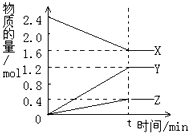 在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.依图所示:
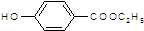
在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.依图所示: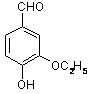 是食品添加剂的增香原料,其香味比香草醛更浓郁.
是食品添加剂的增香原料,其香味比香草醛更浓郁.
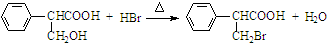 ,属于取代反应(填反应类型).
,属于取代反应(填反应类型).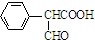 .
.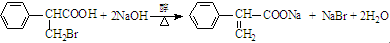 .
. )是一种医药中间体,请设计合理方案用
)是一种医药中间体,请设计合理方案用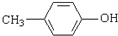 合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).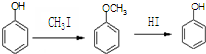
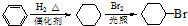
 .
.