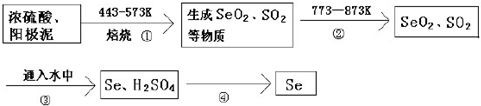
题目内容
9.实验式相同,但既不是同系物,又不是同分异构体的是( )| A. | 1-戊烯和2-甲基-1-丙烯 | B. | 甲醛和甲酸甲酯 | ||
| C. | 1-丁醇和甲乙醚 | D. | 丁酸和乙酸乙酯 |
分析 最简式指用元素符号表示化合物分子中各元素的原子个数比的最简关系式;
同系物指结构相似,在分子组成上相差一个或若干个CH2原子团的物质,具有如下特征:结构相似、化学性质相似、分子式通式相同,分子式不同、物理性质不同,研究范围为有机物;
同分异构体指分子式相同,结构不同的化合物,具有如下特征:分子式相同,结构不同、物理性质不同、不同类时化学性质不同,研究范围多为有机物;
据此结合选项解答.
解答 解:A.1-戊烯和2-甲基-1-丙烯分子式不相同,但结构相似,在分子组成上相差一个CH2,故互为同系物,故A错误;
B.甲醛(HCHO)和甲酸甲酯(HCOOCH3)的最简式相同,都是CH2O,两者结构不相似,分子式不同,两者既不是同系物,也不是同分异构体,故B正确;
C、1-丁醇的分子式为C4H10O,甲乙醚的分子式为C3H8O,故两者的实验式不同,故C错误;
D、丁酸和乙酸乙酯的分子式相同而结构不同,故互为同分异构体,故D错误.
故选B.
点评 本题考查同系物、同分异构体的判断,难度不大,注意化学“四同”比较.

练习册系列答案
相关题目
19.X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列正确的是( )
| A. | 由mXa+与nYb-得,m+a=n-b | |
| B. | 由mXa+与nYb-得X和Y不同周期 | |
| C. | X、Y一定不是同周期元素 | |
| D. | 若X离子是阴离子,则Y离子一定是阳离子 |
20.有机物X是合成绿原酸的重要试剂,其结构如图所示,下列有关X的说法正确的是( )
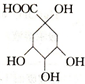

| A. | 1mol X能与5mol NaOH反应 | B. | X能发生加成、取代、氧化反应 | ||
| C. | X的分子式为C7H8O6 | D. | X与乙酸、乙醇均能发生取代反应 |
14.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,11.2L的CHCl3含有的分子数为0.5NA | |
| B. | 28gSi晶体中含有Si-Si键的个数为4NA | |
| C. | 常温下,78g某浓度的乙炔的苯溶液中含碳原子数为6NA | |
| D. | 0.1 molCnH2n+2中含有的碳碳单键数为0.1nNA |
1.NA代表阿伏加德罗常数数值,下列有关叙述正确的是( )
| A. | 28g CO、C2H4混合气体的分子总数NA,体积约为22.4L | |
| B. | 9.2g金属钠投入到足量的重水中所得气体中含有0.4NA中子 | |
| C. | 25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| D. | 0.1mol/LFeCl3溶液中所含Fe3+的数目小于0.1NA |
18.某工厂从废含镍有机催化剂中回收镍的工艺流程如图所示(已知废催化剂中含有Ni 70.0%及一定量的Al、Fe、SiO2和有机物,镍及其化合物的化学性质与铁的类似,但Ni2+的性质较稳定).
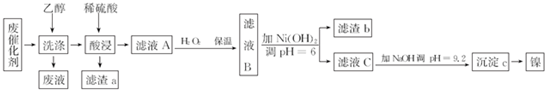
已知:部分阳离子以氢氧化物的形式完全沉淀时的pH如下表所示.
回答下列问题:
(1)滤渣a的成分是SiO2,用乙醇洗涤废催化剂的目的是溶解、除去有机物,从废渣中回收乙醇的方法是蒸馏.
(2)为提高酸浸速率,可采取的措施有将废催化剂粉碎或适当地提高硫酸的浓度、浸泡时的温度(答一条即可).
(3)硫酸酸浸后所得滤液A中可能含有的金属离子是Al3+、Fe2+、Ni2+,向其中加入H2O2的目的是加入H2O2的目的是将Fe2+氧化为Fe3+,有利于分离,反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O.
(4)利用化学镀(待镀件直接置于含有镀层金属的化合物的溶液中)可以在金属、塑料、陶瓷等物品表面镀上一层金属镍或铬等金属.与电镀相比,化学镀的最大优点是不消耗电能,节约能源.
(5)滤液C进行如下所示处理可以制得NiSO4•7HO.滤液C$\stackrel{调PH=3}{→}$溶液D$\stackrel{操作X}{→}$NiSO4•7H2SO
①操作X的名称是蒸发结晶.
②产品晶体中有时会混有少量绿矾(FeSO4•7H2O),可能是由于生产过程中H2O2的用量不足(或H2O2失效)导致Fe2+未被完全氧化.
③NiSO4在强碱溶液中用NaClO氧化,可制得碱性镍镉电池电极材料--NiOOH.该反应的离子方程式是2Ni2++ClO-+4OH-═2NiOOH↓+Cl-+H2O.

已知:部分阳离子以氢氧化物的形式完全沉淀时的pH如下表所示.
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
(1)滤渣a的成分是SiO2,用乙醇洗涤废催化剂的目的是溶解、除去有机物,从废渣中回收乙醇的方法是蒸馏.
(2)为提高酸浸速率,可采取的措施有将废催化剂粉碎或适当地提高硫酸的浓度、浸泡时的温度(答一条即可).
(3)硫酸酸浸后所得滤液A中可能含有的金属离子是Al3+、Fe2+、Ni2+,向其中加入H2O2的目的是加入H2O2的目的是将Fe2+氧化为Fe3+,有利于分离,反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O.
(4)利用化学镀(待镀件直接置于含有镀层金属的化合物的溶液中)可以在金属、塑料、陶瓷等物品表面镀上一层金属镍或铬等金属.与电镀相比,化学镀的最大优点是不消耗电能,节约能源.
(5)滤液C进行如下所示处理可以制得NiSO4•7HO.滤液C$\stackrel{调PH=3}{→}$溶液D$\stackrel{操作X}{→}$NiSO4•7H2SO
①操作X的名称是蒸发结晶.
②产品晶体中有时会混有少量绿矾(FeSO4•7H2O),可能是由于生产过程中H2O2的用量不足(或H2O2失效)导致Fe2+未被完全氧化.
③NiSO4在强碱溶液中用NaClO氧化,可制得碱性镍镉电池电极材料--NiOOH.该反应的离子方程式是2Ni2++ClO-+4OH-═2NiOOH↓+Cl-+H2O.
19.下列有关推断正确的是( )
| A. | SO3 是酸性氧化物,能与NaOH溶液反应 | |
| B. | Na2O、Na2O2组成元素相同,与CO2反应产物也相同 | |
| C. | 金属氧化物一定是碱性氧化物 | |
| D. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
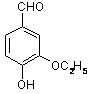 是食品添加剂的增香原料,其香味比香草醛更浓郁.
是食品添加剂的增香原料,其香味比香草醛更浓郁.
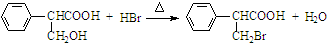 ,属于取代反应(填反应类型).
,属于取代反应(填反应类型).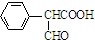 .
.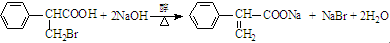 .
.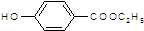 )是一种医药中间体,请设计合理方案用
)是一种医药中间体,请设计合理方案用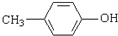 合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).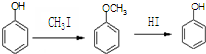
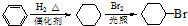
 .
.