题目内容
15.下列操作能使水的电离平衡向右移动,且所得溶液显酸性的是( )| A. | 在水中加入少量NaHCO3固体 | B. | 在水中滴入少量稀硫酸 | ||
| C. | 在水中加入少量氯化铝固体 | D. | 将水加热到100℃,测得pH=6 |
分析 能使水的电离平衡向右移动,说明加入的物质能和氢离子或氢氧根离子反应而促进水的电离;溶液呈酸性,说明加入的物质和氢氧根离子反应,导致溶液中氢氧根离子浓度小于氢离子浓度而使溶液呈酸性.
解答 解:A.碳酸氢钠中的碳酸氢根属于弱酸根离子,结合了水电离的氢离子,溶液显示碱性,故A错误;
B.硫酸电离出氢离子,抑制了水的电离,平衡向逆反应方向移动,故B错误;
C.氯化铝中的铝离子水解,促进了水的电离,平衡向正反应方向移动,溶液显示酸性,故C正确;
D.温度升高,水的电离平衡向正反应方向移动,溶液中的氢离子和氢氧根相等,溶液显示中性,故D错误.
故选C.
点评 本题考查了弱电解质的电离平衡,为高频考点,侧重考查学生的分析能力,明确酸或碱能抑制水的电离、含有弱酸根离子或弱碱离子的盐能促进水的电离是解本题关键,难度不大.

练习册系列答案
相关题目
5.下列离子方程式正确的是( )
| A. | 过氧化钠投入到水中:2Na2O2+2H2O=4Na++4OH-+O2↑ | |
| B. | 氯化铵溶液与浓NaOH 溶液加热:NH4++OH-=NH3•H2O | |
| C. | 氯化铝溶液中滴入过量氨水:Al3++3NH3•H2O=Al(OH)3↓+3 NH4+ | |
| D. | 实验室制取氯气:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++Cl2↑+2Cl-+2H2O |
6. 四种短周期元素X、Y、Z、W的部分信息如表:
四种短周期元素X、Y、Z、W的部分信息如表:
由此回答以下问题:
(1)Y元素在周期表中的位置是第二周期ⅤA族,其单质的电子式是 .
.
(2)W最低价氢化物的水溶液呈弱酸性,其原因用化学用语解释是H2S?H++HS-.
(3)X、Y、Z组成的某种盐的水溶液pH<7,其原因用化学用语解释是NH4++H2O?NH3•H2O+H+,在该溶液中各种离子浓度的大小关系是c(NO3-)>c(NH4+)>c(H+)>c(OH-).
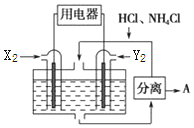
(4)用适当催化剂及电极材料,以HCl一NH4Cl为电解质溶液,构成如图所示的新型电池.
Ⅰ.该电池的正极反应式是N2+8H++6e-=2NH4+.
Ⅱ.分离出物质A的化学式是NH4Cl.
 四种短周期元素X、Y、Z、W的部分信息如表:
四种短周期元素X、Y、Z、W的部分信息如表:| 元素 | 信息 |
| X | 原子半径最小 |
| Y | 单质在空气中含量最高 |
| Z | 其最外层电子数是电子层数的3倍 |
| W | 最高正价与最低负价的代数和为4 |
(1)Y元素在周期表中的位置是第二周期ⅤA族,其单质的电子式是
 .
.(2)W最低价氢化物的水溶液呈弱酸性,其原因用化学用语解释是H2S?H++HS-.
(3)X、Y、Z组成的某种盐的水溶液pH<7,其原因用化学用语解释是NH4++H2O?NH3•H2O+H+,在该溶液中各种离子浓度的大小关系是c(NO3-)>c(NH4+)>c(H+)>c(OH-).
(4)用适当催化剂及电极材料,以HCl一NH4Cl为电解质溶液,构成如图所示的新型电池.
Ⅰ.该电池的正极反应式是N2+8H++6e-=2NH4+.
Ⅱ.分离出物质A的化学式是NH4Cl.
3.有关煤的综合利用下列说法正确的是( )
| A. | 煤和水煤气均是二次能源 | |
| B. | 煤的干馏为化学变化,煤的液化和气化为物理变化 | |
| C. | 煤中含有苯、甲苯、二甲苯等有机物 | |
| D. | 由水煤气转化为甲醇或乙酸时,原子利用率均达到100% |
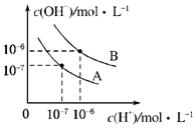 已知水在不同温度下的电离平衡曲线如图所示.(注:以下溶液混合时均不考虑体积的变化)
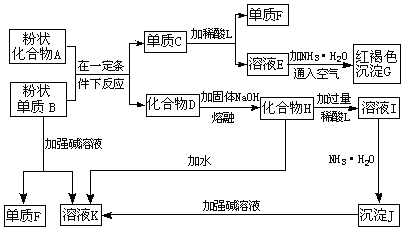
已知水在不同温度下的电离平衡曲线如图所示.(注:以下溶液混合时均不考虑体积的变化) 如图是由常见元素组成的一些单质及其化合物之间的转化关系图.常温常压下,B、E、F、H、I均为气体,F无色无味,且能使澄清石灰水变浑蚀;B、E、I均有刺激性气味,E能使湿润的红色石蕊试纸变蓝,B、E在空气中相遇会产生白烟,I为红棕色.A是一种常见的氮肥,F也能由人直接分解可得到.C、G、K的焰色反应呈黄色.(反应中部分生成物己略去)
如图是由常见元素组成的一些单质及其化合物之间的转化关系图.常温常压下,B、E、F、H、I均为气体,F无色无味,且能使澄清石灰水变浑蚀;B、E、I均有刺激性气味,E能使湿润的红色石蕊试纸变蓝,B、E在空气中相遇会产生白烟,I为红棕色.A是一种常见的氮肥,F也能由人直接分解可得到.C、G、K的焰色反应呈黄色.(反应中部分生成物己略去)
 ;分子M发生加聚反应产物的结构简式
;分子M发生加聚反应产物的结构简式 .
.