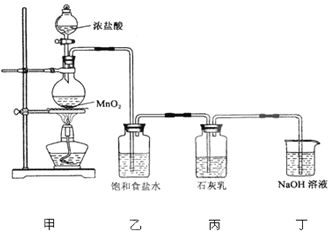
题目内容
1.工业制备硝酸有关反应方程式(原理):N2+3H2$?_{高温高压}^{催化剂}$2NH3、4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O、2NO+O2=2NO2、3NO2+H2O=2HNO3+NO.分析 工业制备硝酸,利用氮气和氢气在高温、高压、催化剂作用下反应生成氨气,氨气催化氧化生成一氧化氮和水,一氧化氮和氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸和一氧化氮,据此书写该化学方程式,以此来解答.
解答 解:工业制备硝酸,首先制取氨气,在高温高压催化剂的条件下,氮气和氢气反应生成氨气,化学方程式为:N2+3H2$?_{高温高压}^{催化剂}$2NH3;
氨气与氧气催化氧化生成NO,发生的反应为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,NO氧化生成二氧化氮,发生的反应为:2NO+O2=2NO2、最后与水反应生成硝酸3NO2+H2O=2HNO3+NO,
故答案为:N2+3H2$?_{高温高压}^{催化剂}$2NH3、4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H20、2NO+O2=2NO2、4NO2+O2+2H2O=4HNO3.
点评 本题考查工业制备硝酸原理,题目难度不大,把握发生的反应原理为解答的关键,侧重性质及化学反应方程式书写的考查,培养了学生灵活应用基础知识的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.下列有关物质的性质与应用的说法正确的是( )
| A. | 甲醇可以使蛋白质变性,常用于食品保鲜 | |
| B. | 氧化铝熔点高,常用子制造耐火材枓 | |
| C. | 氧化钠可用作呼吸面具中的供氧剂 | |
| D. | 常温下,可用铁槽车或铝槽车运输稀硝酸 |
15.下列操作能使水的电离平衡向右移动,且所得溶液显酸性的是( )
| A. | 在水中加入少量NaHCO3固体 | B. | 在水中滴入少量稀硫酸 | ||
| C. | 在水中加入少量氯化铝固体 | D. | 将水加热到100℃,测得pH=6 |
13.在101kPa、25℃时,1.0g乙烷气体完全燃烧生成液态水时,放出热量52.0kJ,则乙烷燃烧的热化学方程式为( )
| A. | C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(l)△H=-1560kJ•mol-1 | |
| B. | 2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g)△H=-1560kJ•mol-1 | |
| C. | C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(l)△H=-52.0kJ•mol-1 | |
| D. | 2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l)△H=+3120 kJ•mol-1 |
10.为了强化安全管理,从油库引进一台空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液).下列说法不正确的是( )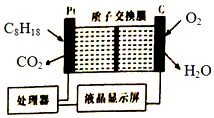

| A. | 石墨电极作正极,发生还原反应 | |
| B. | 铂电极的电极反应式:C8H18+16H2O-50e-═8CO2↑+50H+ | |
| C. | H+由质子交换膜左侧向右侧迁移 | |
| D. | 每消耗5.6LO2,电路中通过1 mol电子 |
11.下列关于电解质的叙述中,不正确的是( )
| A. | 不只是酸、碱、盐类物质才属于电解质 | |
| B. | 氯化钠溶液在电流作用下电离为钠离子与氯离子 | |
| C. | 电解质未必能导电,能导电的也未必是电解质 | |
| D. | 硫酸钡的水溶液虽导电性极弱,但硫酸钡是强电解质 |
 信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门.信息二:氯化铬酰(CrO2Cl2)是铬的一种化合物,常温下该化合物是暗红色液体,熔点为-96.5℃,沸点为117℃,能和丙酮(CH3COCH3)、四氯化碳、CS2等有机溶剂互溶.
信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门.信息二:氯化铬酰(CrO2Cl2)是铬的一种化合物,常温下该化合物是暗红色液体,熔点为-96.5℃,沸点为117℃,能和丙酮(CH3COCH3)、四氯化碳、CS2等有机溶剂互溶.