��Ŀ����
8��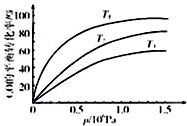 �����仯�������ճ����������Ӧ�ù㷺���о������仯�����Ӧ�������شش��������⣺
�����仯�������ճ����������Ӧ�ù㷺���о������仯�����Ӧ�������شش��������⣺��1����֪��¯���������лᷢ�����·�Ӧ��
FeO��s��+CO��g���TFe��s��+CO2��g����H1
Fe2O3��s��+$\frac{1}{3}$CO��g���T$\frac{2}{3}$Fe3O4��s��+$\frac{1}{3}$CO2��g����H2
Fe3O4��s��+4CO��g���T3Fe��s��+4CO2��g����H3
Fe2O3��s��+3CO��g���T2Fe��s��+3CO2��g����H4
���H4�ı���ʽΪ��H2+$\frac{2}{3}$��H3���ú���H1����H2����H3�Ĵ���ʽ��ʾ����
��2��������Ӧ�ڸ�¯�д��·�Ϊ�����Σ�������Ҫ�ɷ����¶ȵĹ�ϵ���£�
| �¶� | 250�� | 600�� | 1000�� | 2000�� |
| ��Ҫ�ɷ� | Fe2O3 | Fe3O4 | FeO | Fe |
m��Fe����m��O��=35��2����FeO��CO��ԭΪFe�İٷ���Ϊ80%�����������������в���Fe��OԪ�أ���
��3�����Ƚ���������CO��������Ӧ�Ĵ�������֪ij�ִ�������������ӦCO��g��+3H2��g��?CH4��g��+H2O��g����H��0����T�棬106Paʱ��l mol CO��3mol H2��������ɱ���ܱ������У�ʵ����CO���������x��CO�������
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| x��CO�� | 0.25 | 0.23 | 0.214 | 0.202 | 0.193 | 0.193 |
a��������ѹǿ���ٷ����仯
b�����������ܶȲ��ٷ����仯
c��v����CO��=3v����H2��
d����������ƽ����Է����������ٷ����仯
�ڴﵽƽ��ʱCO��ת����Ϊ37.1%��
��ͼ��ʾ�÷�ӦCO��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ���¶�T1��T2��T3�ɸߵ��͵�˳����T3��T2��T1������������Ӧ���ȣ�����ͬѹǿ�£��¶Ƚ��ͣ�ƽ��������Ӧ�����ƶ���CO��ת����Խ�ߣ���
���� ��1�����ݸ�˹���ɣ��������ķ�Ӧ��+�ۡ�$\frac{2}{3}$�ɵã�Fe2O3��s��+3CO��g���T2Fe��s��+3CO2��g������Ӧ������Ӧ�ı仯���ɣ�
��2�����ݵ�1000��ʱΪFeO����2000��ʱΪFe����������������FeO�����ʵ���Ϊxmol��Fe�����ʵ���Ϊymol�����У�$\frac{x+y}{x}=\frac{\frac{35}{56}}{\frac{2}{16}}$���������x��y��
��3���ٵ�һ�������ڷ�Ӧ��ƽ��֮ǰ�ڱ仯�������������ˣ�����˵����Ӧ��ƽ�⣻
���跴Ӧ��ƽ��ʱCOת����xmol����������ʽ���ƽ��ʱCO��������������㣻
�۷�ӦCO��g��+3H2��g��?CH4��g��+H2O��g����H��0���¶�Խ�ߣ���ƽ�����ƣ�CO��ƽ��ת����Խ�ͣ�
��� �⣺��1����֪��Ӧ��Fe2O3��s��+$\frac{1}{3}$CO��g���T$\frac{2}{3}$Fe3O4��s��+$\frac{1}{3}$CO2��g����H2 ��
Fe3O4��s��+4CO��g���T3Fe��s��+4CO2��g����H3 ��
���ݸ�˹���ɣ��������ķ�Ӧ��+�ۡ�$\frac{2}{3}$�ɵã�Fe2O3��s��+3CO��g���T2Fe��s��+3CO2��g�����ʡ�H4=��H2+$\frac{2}{3}$��H3��
�ʴ�Ϊ����H2+$\frac{2}{3}$��H3
��2�����ݵ�1000��ʱΪFeO����2000��ʱΪFe����������������FeO�����ʵ���Ϊxmol��Fe�����ʵ���Ϊymol�����У�$\frac{x+y}{x}=\frac{\frac{35}{56}}{\frac{2}{16}}$���������x��y=1��4����ʣ���FeO�ͱ���ԭΪ����FeO�����ʵ���֮��Ϊ1��4�����֪����ԭ��FeO�İٷֱ�Ϊ$\frac{4}{1+4}��100%=80%$
�ʴ�Ϊ��FeO��Fe�� 80%
��3����a�����ڴ������Ǹ�����ɱ����������Ϊ���ݵ���������������ѹǿһֱ���䣬�ʲ�����Ϊ��Ӧ��ƽ��ı�־����a����
b���˷�Ӧ��ƽ��ǰ��������������䣬�������С�����ܶȱ�ʵ����������ܶȲ��ٷ����仯ʱ��˵����Ӧ��ƽ�⣬��b��ȷ��
c����Ӧ��ƽ��ĸ�����־��v��=v��������3v����CO��=v����H2������c����
d���ڷ�Ӧ��ƽ��֮ǰ�����������������䣬�����ʵ�����С���ʻ�������ƽ����Է��������ڱ�С���ʵ�����ʱ��˵����Ӧ��ƽ�⣬��d��ȷ��
��ѡbd��
���跴Ӧ��ƽ��ʱCOת����xmol�����������ʽ��֪��
CO��g��+3H2��g��?CH4��g��+H2O��g��
��ʼ��n����1mol 3mol 0 0
��n��xmol 3xmol xmol xmol
ƽ�⣨n������1-x��mol��3-3x��mol xmol xmol
���ƽ��ʱCO���������Ϊ0.193��֪��$\frac{1-x}{4-2x}=0.193$�����x=0.371���ʴﵽƽ��ʱCO��ת����Ϊ=$\frac{0.371mol}{1mol}$=37.1%
�ʴ�Ϊ��37.1%
�۷�ӦCO��g��+3H2��g��?CH4��g��+H2O��g����H��0���¶�Խ�ߣ���ƽ�����ƣ�CO��ƽ��ת����Խ�ͣ�����ͼ���֪���¶�T3��T2��T1��
�ʴ�Ϊ��T3��T2��T1������Ӧ���ȣ�����ͬѹǿ�£��¶Ƚ��ͣ�ƽ��������Ӧ�����ƶ���CO��ת����Խ�ߣ�
���� �����ۺϿ����˸�˹���ɵ�Ӧ�á�ƽ�ⳣ���������ͼ���Ӧ�ã��ۺ��Խ�ǿ��һֱ�Ǹ߿��ij������ͣ���Ŀ�Ѷ��еȣ�

| A�� | ú�Ϳ���ʯ�ͷ����ã�������ȼ�Ϻͱ������������� | |
| B�� | ʯ���ǻ���������Ʒ����Ϊ������ | |
| C�� | ú������Ҫ�õ���̿��ú���͡��ְ�ˮ�ͽ�¯�� | |
| D�� | ʯ�ͷ���ɻ�����ᡢ������������ |
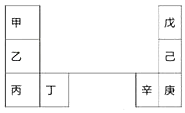 �ס�����Ԫ�������ڱ��е����λ������������ԭ���������3�����һ�ֵ�������Ȼ��Ӳ���������ʣ������ж���ȷ���ǣ�������
�ס�����Ԫ�������ڱ��е����λ������������ԭ���������3�����һ�ֵ�������Ȼ��Ӳ���������ʣ������ж���ȷ���ǣ�������| A�� | �����ԣ��ף��ң��� | |
| B�� | ԭ�Ӱ뾶������������ | |
| C�� | ������ԭ�Ӻ�����������11 | |
| D�� | �ҵĵ����ڿ�����ȼ������ֻ�����Ӽ��Ļ����� |
| �¶�/�� | 700 | 800 | 830 | 1000 | 1200 |
| ƽ�ⳣ�� | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
��1���÷�Ӧƽ�ⳣ������ʽΪK=$\frac{c��C��•c��D��}{c��A��•c��B��}$����H��0��ѡ���������������=������
��2��830��ʱ����һ��5L���ܱ������г���0.20mol��A��0.80mol��B������÷�Ӧ��ʼ��6S��A��ƽ����Ӧ����v��A��=0.002mol•L-1•S-1����6Sʱc��A��=0.028 mol•L-1��C�����ʵ���Ϊ0.06mol��
��3�����루2����ͬ���¶ȡ�������A��B����·�Ӧ��һ��ʱ���ﵽƽ�⣬��ʱA��ת����Ϊ80%�������¶ȡ��������䣬�����ܱ������г���0.20mol��A��0.80mol��B����ʱA��ת����Ϊ80%�������ʱ����ܱ��������ٳ���1mol�������ƽ��ʱA��ת���ʲ��䣨ѡ���������С���������䡱����
��4���жϸ÷�Ӧ�Ƿ�ﵽƽ�������Ϊce������ȷѡ�����ĸ����
a��ѹǿ����ʱ��ı�
b��������ܶȲ���ʱ��ı�
c��c��A������ʱ��ı�
d����λʱ��������C��D�����ʵ������
e����λʱ��������amolA��ͬʱ������amolB
��5��1200��ʱ��ӦC��g��+D��g��?A��g��+B��g����ƽ�ⳣ����ֵΪ2.5��
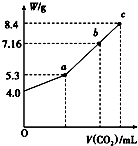 ��100mL��NaOH��Һ��ͨ��CO2��ַ�Ӧ���ڼ�ѹ�ͽϵ��¶��£�С�ĵؽ���Һ���ɣ��õ���ɫ����M��ͨ��CO2���������״������M������W�Ĺ�ϵ��ͼ��ʾ���Իش��������⣺
��100mL��NaOH��Һ��ͨ��CO2��ַ�Ӧ���ڼ�ѹ�ͽϵ��¶��£�С�ĵؽ���Һ���ɣ��õ���ɫ����M��ͨ��CO2���������״������M������W�Ĺ�ϵ��ͼ��ʾ���Իش��������⣺ �Ȼ�����һ����Ҫ�Ļ���ԭ�ϣ�����Ȼ�����Һ���Ƶ��������������Ƶ����ʣ������Ļ�ѧ��Ӧ���£�2NaCl+2H2O$\frac{\underline{\;���\;}}{\;}$Cl2��+H2��+2NaOH����ȡһ��������������������Ϊ10%���Ȼ�����Һ���е�⣬���Ȼ�����ȫ��Ӧʱ��ֹͣͨ�磮����������������ʱ��Ĺ�ϵ��ͼ��ʾ������㣺
�Ȼ�����һ����Ҫ�Ļ���ԭ�ϣ�����Ȼ�����Һ���Ƶ��������������Ƶ����ʣ������Ļ�ѧ��Ӧ���£�2NaCl+2H2O$\frac{\underline{\;���\;}}{\;}$Cl2��+H2��+2NaOH����ȡһ��������������������Ϊ10%���Ȼ�����Һ���е�⣬���Ȼ�����ȫ��Ӧʱ��ֹͣͨ�磮����������������ʱ��Ĺ�ϵ��ͼ��ʾ������㣺