题目内容
17.下列关于化石燃料的加工说法正确的是( )| A. | 煤油可由石油分馏获得,可用作燃料和保存少量金属钠 | |
| B. | 石油是混合物,其分馏产品汽油为纯净物 | |
| C. | 煤干馏主要得到焦炭、煤焦油、粗氨水和焦炉气 | |
| D. | 石油分馏可获得乙酸、苯及其衍生物 |
分析 A.煤油为石油的分馏产物,与钠不反应,且密度比钠小;
B.汽油是多种烃的混合物,主要是辛烷;
C.煤干馏是煤在隔绝条件下,高温发生复杂的化学变化;
D.石油是多种烃的混合物.
解答 解:A.煤油为石油的分馏产物,与钠不反应,且密度比钠小,可用于保存钠,可以隔绝空气,防止空气中的成分与Na反应,故A正确;
B.石油是混合物,其分馏产品汽油是一定温度范围内的馏分,汽油属于多种烃的混合物,主要是辛烷,故B错误;
C.煤干馏是煤在隔绝条件下,高温发生复杂的化学变化,煤干馏主要得到焦炭、煤焦油、粗氨水和焦炉气,故C正确;
D.石油是多种烃的混合物,苯及其衍生物主要通过石油的催化重整获得,石油中没有乙酸,石油分馏不能得到乙酸,故D错误.
故选AC.
点评 本题考查了煤的干馏和石油的分馏,为高考常见题型,侧重于学生的分析能力和应用能力的考查,注意把握石油的成分,题目难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
5.在甲酸的下列性质中,可以证明它是弱电解质的是( )
| A. | 1mol/L甲酸溶液中c(H+)约为1×10-2mol/L | |
| B. | 甲酸能与水以任意比互溶 | |
| C. | 10mL 1mol/L甲酸恰好跟10 mL 1mol/L NaOH溶液完全反应 | |
| D. | 甲酸的导电性比强酸溶液的导电性弱 |
12.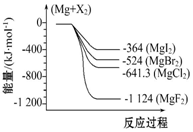 如图是金属镁和卤素反应的能量变化图(反应物和生成物均为298K时的稳定状态).下列选项中不正确的是( )
如图是金属镁和卤素反应的能量变化图(反应物和生成物均为298K时的稳定状态).下列选项中不正确的是( )
 如图是金属镁和卤素反应的能量变化图(反应物和生成物均为298K时的稳定状态).下列选项中不正确的是( )
如图是金属镁和卤素反应的能量变化图(反应物和生成物均为298K时的稳定状态).下列选项中不正确的是( )| A. | Mg与F2反应放热最多 | |
| B. | MgF2(s)+Br2(l)═MgBr2(s)+F2(g)吸热 | |
| C. | MgBr2与Cl2反应放热 | |
| D. | 化合物的热稳定顺序:MgI2>MgBr2>MgCl2>MgF2 |
2.常温下能共存,且能用浓H2SO4干燥的一组气体是( )
| A. | O2、SO2 | B. | NH3、N2 | C. | NO、O2 | D. | NH3、HCl |
9. 近日,雾霾又上了度娘热搜榜.其主要成分包括灰尘、SO2、NOx、有机碳氢化合物等粒子.烟气脱硝是治理雾霾的方法之一.
近日,雾霾又上了度娘热搜榜.其主要成分包括灰尘、SO2、NOx、有机碳氢化合物等粒子.烟气脱硝是治理雾霾的方法之一.
(1)氨气是常见的烟气脱硝剂之一,其脱硝原理是与NO(g)反应生成空气中存在的两种无毒物质.
①写出该反应的化学反应方程式:4NH3+6NO=5N2+6H2O.
②已知:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H1=-907.28kJ•mol-1;
4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H2=-1269.02kJ•mol-1.105℃时,则上述脱硝反应的△H=-1811.63kJ•mol-1,该反应能(填“能”“否”或“不能确定”)自发进行,
③上述脱硝反应中氧化剂和还原剂的物质的量之比为3:2.每生成1mol还原产物,则反应中转移电子数为4mol.
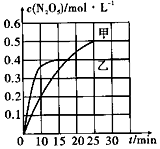
(2)臭氧也是理想的烟气脱硝剂,其脱硝的反应之一为2NO2(g)+O3(g)?N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生上述反应,相关信息如表及如图所示,回答下列问题:
①0~10min内甲容器中反应的平均速率:v(O3)=mol•L-1•min-1.
②T1<T2(填“>”“<”或“=”),T1时,该反应的平衡常数为0.5L•mol-1.
③下列措施能提高容器乙中NO2转化率的是D (填序号).
A.向容器中充入He,增大容器的压强 B.升高容器的温度
C.向容器中再充人一定量的NO2D.向容器中再充入lmol O3和2mo NO2
④T1时,若起始时向容器甲中充入2mo1NO2、lmolO3、2mollN2O5和2molO2,则脱硝反应达到平衡前,
v(正)<v(逆) (填“>”“<”“=”).
 近日,雾霾又上了度娘热搜榜.其主要成分包括灰尘、SO2、NOx、有机碳氢化合物等粒子.烟气脱硝是治理雾霾的方法之一.
近日,雾霾又上了度娘热搜榜.其主要成分包括灰尘、SO2、NOx、有机碳氢化合物等粒子.烟气脱硝是治理雾霾的方法之一.(1)氨气是常见的烟气脱硝剂之一,其脱硝原理是与NO(g)反应生成空气中存在的两种无毒物质.
①写出该反应的化学反应方程式:4NH3+6NO=5N2+6H2O.
②已知:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H1=-907.28kJ•mol-1;
4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H2=-1269.02kJ•mol-1.105℃时,则上述脱硝反应的△H=-1811.63kJ•mol-1,该反应能(填“能”“否”或“不能确定”)自发进行,
③上述脱硝反应中氧化剂和还原剂的物质的量之比为3:2.每生成1mol还原产物,则反应中转移电子数为4mol.
(2)臭氧也是理想的烟气脱硝剂,其脱硝的反应之一为2NO2(g)+O3(g)?N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生上述反应,相关信息如表及如图所示,回答下列问题:
| 容器 | 甲 | 乙 |
| 容积/L | 1 | 1 |
| 温度/K | T1 | T2 |
| 起始充入量 | lmolO32mol NO2 | lmolO3 2mol NO2 |
②T1<T2(填“>”“<”或“=”),T1时,该反应的平衡常数为0.5L•mol-1.
③下列措施能提高容器乙中NO2转化率的是D (填序号).
A.向容器中充入He,增大容器的压强 B.升高容器的温度
C.向容器中再充人一定量的NO2D.向容器中再充入lmol O3和2mo NO2
④T1时,若起始时向容器甲中充入2mo1NO2、lmolO3、2mollN2O5和2molO2,则脱硝反应达到平衡前,
v(正)<v(逆) (填“>”“<”“=”).
6.下列有关反应和反应类型不相符的是( )
| A. | 甲苯与浓硝酸、浓硫酸混合反应制TNT (取代反应) | |
| B. | 苯与乙烯在催化剂存在下反应制取乙苯 (取代反应) | |
| C. | 甲苯与酸性KMnO4溶液反应 (氧化反应) | |
| D. | 甲苯制取甲基环已烷 (加成反应) |
8. 铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:
铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:
(1)已知高炉炼铁过程中会发生如下反应:
FeO(s)+CO(g)═Fe(s)+CO2(g)△H1
Fe2O3(s)+$\frac{1}{3}$CO(g)═$\frac{2}{3}$Fe3O4(s)+$\frac{1}{3}$CO2(g)△H2
Fe3O4(s)+4CO(g)═3Fe(s)+4CO2(g)△H3
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H4
则△H4的表达式为△H2+$\frac{2}{3}$△H3(用含△H1、△H2、△H3的代数式表示).
(2)上述反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如下:
1600℃时固体物质的主要成分为FeO和Fe,该温度下若测得固体混合物中.
m(Fe):m(O)=35:2,则FeO被CO还原为Fe的百分率为80%(设其它固体杂质中不含Fe、O元素).
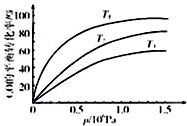
(3)铁等金属可用作CO与氢气反应的催化剂.已知某种催化剂可用来催化反应CO(g)+3H2(g)?CH4(g)+H2O(g)△H<0.在T℃,106Pa时将l mol CO和3mol H2加入体积可变的密闭容器中.实验测得CO的体积分数x(CO)如表:
①能判断CO(g)+3H2(g)?CH4(g)+H2O(g)达到平衡的是bd(填序号).
a.容器内压强不再发生变化
b.混合气体的密度不再发生变化
c.v正(CO)=3v逆(H2)
d.混合气体的平均相对分子质量不再发生变化
②达到平衡时CO的转化率为37.1%;
③图表示该反应CO的平衡转化率与温度、压强的关系.图中温度T1、T2、T3由高到低的顺序是T3>T2>T1,理由是正反应放热,在相同压强下,温度降低,平衡向正反应方向移动,CO的转化率越高..
 铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:
铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:(1)已知高炉炼铁过程中会发生如下反应:
FeO(s)+CO(g)═Fe(s)+CO2(g)△H1
Fe2O3(s)+$\frac{1}{3}$CO(g)═$\frac{2}{3}$Fe3O4(s)+$\frac{1}{3}$CO2(g)△H2
Fe3O4(s)+4CO(g)═3Fe(s)+4CO2(g)△H3
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H4
则△H4的表达式为△H2+$\frac{2}{3}$△H3(用含△H1、△H2、△H3的代数式表示).
(2)上述反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如下:
| 温度 | 250℃ | 600℃ | 1000℃ | 2000℃ |
| 主要成分 | Fe2O3 | Fe3O4 | FeO | Fe |
m(Fe):m(O)=35:2,则FeO被CO还原为Fe的百分率为80%(设其它固体杂质中不含Fe、O元素).
(3)铁等金属可用作CO与氢气反应的催化剂.已知某种催化剂可用来催化反应CO(g)+3H2(g)?CH4(g)+H2O(g)△H<0.在T℃,106Pa时将l mol CO和3mol H2加入体积可变的密闭容器中.实验测得CO的体积分数x(CO)如表:
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| x(CO) | 0.25 | 0.23 | 0.214 | 0.202 | 0.193 | 0.193 |
a.容器内压强不再发生变化
b.混合气体的密度不再发生变化
c.v正(CO)=3v逆(H2)
d.混合气体的平均相对分子质量不再发生变化
②达到平衡时CO的转化率为37.1%;
③图表示该反应CO的平衡转化率与温度、压强的关系.图中温度T1、T2、T3由高到低的顺序是T3>T2>T1,理由是正反应放热,在相同压强下,温度降低,平衡向正反应方向移动,CO的转化率越高..
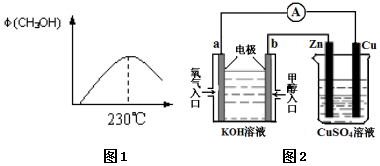 能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一.
能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一. 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出热量可计算中和热.回答下列问题: