题目内容
17.利用下列实验用品:①铁架台(含铁圈、各种铁夹);②锥形瓶;③滴定管(酸式与碱式);④烧杯(若干个);⑤玻璃棒;⑥天平(含砝码);⑦滤纸;⑧量筒;⑨漏斗Na2CO3固体;标准NaOH溶液;未知浓度盐酸;Na2CO3溶液.
进行下列实验或操作:
(1)做酸碱中和滴定时,还缺少的试剂是:指示剂(甲基橙或酚酞)、蒸馏水.
(2)配制250mL 0.1mol•L-1某溶液时,还缺少的仪器是:250mL容量瓶、胶头滴管.
(3)过滤时,应选用上述仪器中的①④⑤⑦⑨(填偏号).
分析 (1)除给出的仪器外,还需要指示剂判断滴定终点,需要蒸馏水洗涤仪器;
(2)配制250mL 0.1mol•L-1某溶液时,需要250mL容量瓶,在烧杯中溶解或稀释,冷却后转移到容量瓶中定容;
(3)过滤时需要铁架台、漏斗、烧杯、玻璃棒、滤纸.
解答 解:(1)做酸碱中和滴定时,需要铁架台、锥形瓶、滴定管、标准液、未知液,还缺少的试剂是指示剂(甲基橙或酚酞)、蒸馏水,
故答案为:指示剂(甲基橙或酚酞)、蒸馏水;
(2)配制250mL 0.1mol•L-1某溶液时,需要250mL容量瓶,在烧杯中溶解或稀释,冷却后转移到容量瓶中定容,用胶头滴管滴加,缺少250mL容量瓶、胶头滴管,
故答案为:250mL容量瓶、胶头滴管;
(3)过滤时需要铁架台、漏斗、烧杯、玻璃棒、滤纸,则应选用上述仪器中的①④⑤⑦⑨,
故答案为:①④⑤⑦⑨.
点评 本题考查中和滴定、溶液配制及过滤,为高频考点,把握仪器的实验、实验操作和技能为解答的关键,侧重分析与实验能力的考查,注意常见仪器的用途,题目难度不大.

练习册系列答案
相关题目
6.下列有关反应和反应类型不相符的是( )
| A. | 甲苯与浓硝酸、浓硫酸混合反应制TNT (取代反应) | |
| B. | 苯与乙烯在催化剂存在下反应制取乙苯 (取代反应) | |
| C. | 甲苯与酸性KMnO4溶液反应 (氧化反应) | |
| D. | 甲苯制取甲基环已烷 (加成反应) |
8. 铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:
铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:
(1)已知高炉炼铁过程中会发生如下反应:
FeO(s)+CO(g)═Fe(s)+CO2(g)△H1
Fe2O3(s)+$\frac{1}{3}$CO(g)═$\frac{2}{3}$Fe3O4(s)+$\frac{1}{3}$CO2(g)△H2
Fe3O4(s)+4CO(g)═3Fe(s)+4CO2(g)△H3
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H4
则△H4的表达式为△H2+$\frac{2}{3}$△H3(用含△H1、△H2、△H3的代数式表示).
(2)上述反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如下:
1600℃时固体物质的主要成分为FeO和Fe,该温度下若测得固体混合物中.
m(Fe):m(O)=35:2,则FeO被CO还原为Fe的百分率为80%(设其它固体杂质中不含Fe、O元素).
(3)铁等金属可用作CO与氢气反应的催化剂.已知某种催化剂可用来催化反应CO(g)+3H2(g)?CH4(g)+H2O(g)△H<0.在T℃,106Pa时将l mol CO和3mol H2加入体积可变的密闭容器中.实验测得CO的体积分数x(CO)如表:
①能判断CO(g)+3H2(g)?CH4(g)+H2O(g)达到平衡的是bd(填序号).
a.容器内压强不再发生变化
b.混合气体的密度不再发生变化
c.v正(CO)=3v逆(H2)
d.混合气体的平均相对分子质量不再发生变化
②达到平衡时CO的转化率为37.1%;
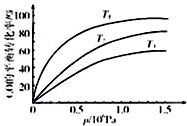
③图表示该反应CO的平衡转化率与温度、压强的关系.图中温度T1、T2、T3由高到低的顺序是T3>T2>T1,理由是正反应放热,在相同压强下,温度降低,平衡向正反应方向移动,CO的转化率越高..
 铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:
铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:(1)已知高炉炼铁过程中会发生如下反应:
FeO(s)+CO(g)═Fe(s)+CO2(g)△H1
Fe2O3(s)+$\frac{1}{3}$CO(g)═$\frac{2}{3}$Fe3O4(s)+$\frac{1}{3}$CO2(g)△H2
Fe3O4(s)+4CO(g)═3Fe(s)+4CO2(g)△H3
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H4
则△H4的表达式为△H2+$\frac{2}{3}$△H3(用含△H1、△H2、△H3的代数式表示).
(2)上述反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如下:
| 温度 | 250℃ | 600℃ | 1000℃ | 2000℃ |
| 主要成分 | Fe2O3 | Fe3O4 | FeO | Fe |
m(Fe):m(O)=35:2,则FeO被CO还原为Fe的百分率为80%(设其它固体杂质中不含Fe、O元素).
(3)铁等金属可用作CO与氢气反应的催化剂.已知某种催化剂可用来催化反应CO(g)+3H2(g)?CH4(g)+H2O(g)△H<0.在T℃,106Pa时将l mol CO和3mol H2加入体积可变的密闭容器中.实验测得CO的体积分数x(CO)如表:
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| x(CO) | 0.25 | 0.23 | 0.214 | 0.202 | 0.193 | 0.193 |
a.容器内压强不再发生变化
b.混合气体的密度不再发生变化
c.v正(CO)=3v逆(H2)
d.混合气体的平均相对分子质量不再发生变化
②达到平衡时CO的转化率为37.1%;
③图表示该反应CO的平衡转化率与温度、压强的关系.图中温度T1、T2、T3由高到低的顺序是T3>T2>T1,理由是正反应放热,在相同压强下,温度降低,平衡向正反应方向移动,CO的转化率越高..
2.下列关于物质的用途正确的是( )
| A. | 在医疗上碳酸钠、Al(OH)3均可用于治疗胃酸过多 | |
| B. | 人造刚玉的熔点很高,可用作高级耐火材料,其主要成分是SiO2 | |
| C. | 水玻璃可用于生产粘合剂和防火剂 | |
| D. | 自来水中加入少量明矾,水解生成Al(OH)3胶体可以起到杀菌消毒的作用 |
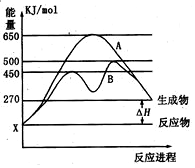 (1)已知:Fe(s)+$\frac{1}{2}$O2(g)=FeO(s),△H=-272.0KJ•mol-1
(1)已知:Fe(s)+$\frac{1}{2}$O2(g)=FeO(s),△H=-272.0KJ•mol-1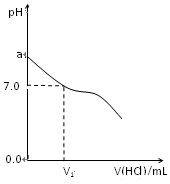 常温下,在20.0mL 0.20mol/LCH3COONa溶液中滴加0.20mol/L的稀盐酸.溶液的PH值的变化关系如图所示.
常温下,在20.0mL 0.20mol/LCH3COONa溶液中滴加0.20mol/L的稀盐酸.溶液的PH值的变化关系如图所示.