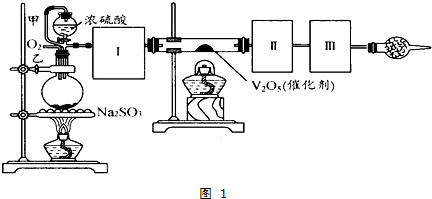
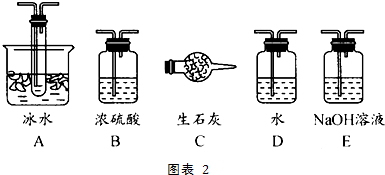
题目内容
1.将Mg、Cu组成的26.4g混合物投入到适量的稀硝酸中,固体完全溶解,将产生的气体和6.72L(标准状况下)氧气混合通入水中,恰好全部被水吸收.向反应后的溶液中加入足量的4mol/L-1的NaOH溶液,使金属离子完全沉淀.则形成沉淀的质量是( )| A. | 63.8g | B. | 53.6g | C. | 46.8g | D. | 43.2g |
分析 Mg、Cu在反应中失去电子,最终生成Mg(OH)2、Cu(OH)2,则可知失去电子的物质的量等于生成沉淀需要氢氧根离子的物质的量,根据生成NO的气体的物质的量,可知反应中转移电子的物质的量,结合氧化还原反应得失电子数目相等,可知最终生成沉淀的质量.
解答 解:反应中Cu$\stackrel{-2e-}{→}$Cu2+$\stackrel{2OH-}{→}$Cu(OH)2,Mg$\stackrel{-2e-}{→}$Mg2+$\stackrel{2OH-}{→}$Mg(OH)2,可知Mg、Cu在反应中失去电子的物质的量等于生成沉淀需要氢氧根离子的物质的量,
根据反应:4NO+3O2+2H2O=4HNO3,消耗6.72LO2转移的电子为$\frac{6.72L}{22.4L/mol}$×4=1.2mol,可知Mg、Cu在反应中失去电子的物质的量等于
消耗氧气得到电子的物质的量,即1.2mol,所以反应后生成沉淀的质量为26.4g+1.2mol×17g/mol=46.8g.
故选C.
点评 考查混合物的计算,难度中等,解题关键是判断沉淀质量为金属与金属离子结合氢氧根离子的质量之和,Mg、Cu在反应中失去电子的物质的量等于生成沉淀需要氢氧根离子的物质的量,注意电子守恒在解题中的应用.

练习册系列答案
相关题目
12.O3和O2在酸性条件下都能氧化海水中的I-得到碘单质,现将O3通入稀硫酸酸化的NaI溶液中进行模拟研究.
(1)用一个离子反应方程式表示该模拟实验中发生的反应:O3+6I-+6H+=3H2O+3I2
(2)为探究外界条件对I2生成速率的影响,做了如下三组实验,(其中O3、H2SO4、NaI的量都相同,溶液的体积均为20mL)填写表中的空白处.
(3)在该模拟实验中要测试是否有I2生成,需要加入一种试剂的名称是淀粉溶液(或淀粉试剂)
(4)有同学建议将FeCl2换成FeSO4更能准确的反映某种微粒对该化学反应速率有影响,则该同学的实验目的是排除Cl-的干扰,探究Fe2+对该反应速率的影响(或探究Fe2+对该反应是否有催化作用).
(1)用一个离子反应方程式表示该模拟实验中发生的反应:O3+6I-+6H+=3H2O+3I2
(2)为探究外界条件对I2生成速率的影响,做了如下三组实验,(其中O3、H2SO4、NaI的量都相同,溶液的体积均为20mL)填写表中的空白处.
| 编号 | 实验目的 | 反应物 | 反应前溶液的pH | 温度 |
| I | 对照实验 | O3+H2SO4+NaI | 5 | 25℃ |
| II | ① 探究FeCl2对反应速率的影响 | O3+H2SO4+NaI+FeCl2 | 5 | ? |
| III | 探究温度对速率的影响 | O3+H2SO4+NaI | ③ 5 | 5℃ |
(4)有同学建议将FeCl2换成FeSO4更能准确的反映某种微粒对该化学反应速率有影响,则该同学的实验目的是排除Cl-的干扰,探究Fe2+对该反应速率的影响(或探究Fe2+对该反应是否有催化作用).
16.下列叙述正确的是( )
| A. | 用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 | |
| B. | 在原电池的负极和电解池的阴极上都是发生失电子的氧化反应 | |
| C. | 用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH | |
| D. | 镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
6.2016年4月16日凌晨日本南部九州地区发生的7.3级地震,九州阿苏地区发生了大规模山体滑坡及火山爆发,其周边区域的空气中漂浮着放射性物质,其中含有碘的同位素13153I,13153I中的质子数为( )
| A. | 53 | B. | 78 | C. | 131 | D. | 184 |
11.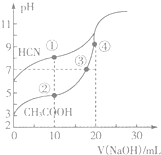 常温下,用0.10mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.10mol•L-1的CH3COOH溶液和HCN溶液,滴定曲线如图所示.下列说法不正确的是( )
常温下,用0.10mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.10mol•L-1的CH3COOH溶液和HCN溶液,滴定曲线如图所示.下列说法不正确的是( )
 常温下,用0.10mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.10mol•L-1的CH3COOH溶液和HCN溶液,滴定曲线如图所示.下列说法不正确的是( )
常温下,用0.10mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.10mol•L-1的CH3COOH溶液和HCN溶液,滴定曲线如图所示.下列说法不正确的是( )| A. | 点①溶液的c(CN-)<点②溶液的c(CH3COO-) | |
| B. | 点②溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) | |
| C. | 点③溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| D. | 点④溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |