题目内容
16.下列叙述正确的是( )| A. | 用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 | |
| B. | 在原电池的负极和电解池的阴极上都是发生失电子的氧化反应 | |
| C. | 用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH | |
| D. | 镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
分析 A.惰性电极电解Na2SO4溶液,实质是电解水,阳极是氢氧根离子失电子生成氧气,阴极是氢离子得到电子生成氢气;
B.得电子的发生还原反应,失电子的发生氧化反应;
C.根据氢氧化钠和转移电子之间的关系式计算;
D.作原电池负极的金属比作原电池正极的金属易腐蚀.
解答 解:A.惰性电极电解Na2SO4溶液,实质是电解水,阴极上析出氢气,阳极上析出氧气,氢离子得2mol电子生成1mol氢气,4mol氢氧根离子失去4mol电子生成1mol氧气,所以阴阳两极产物的物质的量之比为2:1,故A错误;
B.在原电池的负极是发生失电子的氧化反应,电解池阴极上得电子发生还原反应,故B错误;
C.设生成x氢氧化钠,
2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑转移电子
2mol 2mol
x 1mol
x=$\frac{2mol×1mol}{2mol}$=1mol,
所以生成1mol氢氧化钠,故C正确;
D.镀层破损后,镀锡铁板中铁作负极,镀锌铁板中铁作正极,所以镀锌铁板比镀锡铁板更耐腐蚀,故D错误;
故选C.
点评 本题考查了原电池和电解池原理,难度不大,注意选项A中生成1mol氧气需要转移4mol电子.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.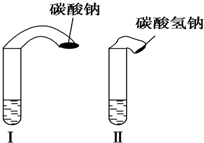 高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸(均足量)(只有浓度小于1mol•L-1的稀盐酸跟Na2CO3和NaHCO3反应才能根据反应的剧烈程度区分开来,浓度较高则反应现象都是同样的剧烈),将两个各装有0.3g NaHCO3和Na2CO3粉末的小气球分别套在两支试管口上.将气球内的NaHCO3或NNa2CO3同时倒入试管中,观察到现象如下:
高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸(均足量)(只有浓度小于1mol•L-1的稀盐酸跟Na2CO3和NaHCO3反应才能根据反应的剧烈程度区分开来,浓度较高则反应现象都是同样的剧烈),将两个各装有0.3g NaHCO3和Na2CO3粉末的小气球分别套在两支试管口上.将气球内的NaHCO3或NNa2CO3同时倒入试管中,观察到现象如下:
①试管中(填产生沉淀或气体及反应速率等相关现象)两支试管中都产生大量气泡,但盛NaHCO3的试管中反应速率要快得多;
②试管中气球大小(包含试管)体积之比约为(填最简单整数比)Ⅰ:Ⅱ=42:53;
③甲同学用手触摸试管,发现盛NaHCO3粉末的试管变凉,而盛Na2CO3粉末的试管温度有升高.由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应.
甲得出的结论是否正确不正确(填“正确”或“不正确”).
为研究是吸热反应还是放热反应,继续进行了下列实验(每次实验各做3次平行实验,取平均值):(注:每组固体全溶解且完全反应)
请你帮助填写相关内容:
(1)该研究报告的题目是《NaHCO3、Na2CO3和盐酸反应过程中热效应的研究》;
(2)该实验中所用的仪器除试管、药匙(或V形纸槽)、气球、下端带环状玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称为托盘天平和温度计;
(3)通过上述实验可得出两条结论:
a.Na2CO3溶液和盐酸的反应是放热(吸热或放热)反应;
b.NaHCO3溶液和盐酸的反应是吸热(吸热或放热)反应.
 高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸(均足量)(只有浓度小于1mol•L-1的稀盐酸跟Na2CO3和NaHCO3反应才能根据反应的剧烈程度区分开来,浓度较高则反应现象都是同样的剧烈),将两个各装有0.3g NaHCO3和Na2CO3粉末的小气球分别套在两支试管口上.将气球内的NaHCO3或NNa2CO3同时倒入试管中,观察到现象如下:
高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸(均足量)(只有浓度小于1mol•L-1的稀盐酸跟Na2CO3和NaHCO3反应才能根据反应的剧烈程度区分开来,浓度较高则反应现象都是同样的剧烈),将两个各装有0.3g NaHCO3和Na2CO3粉末的小气球分别套在两支试管口上.将气球内的NaHCO3或NNa2CO3同时倒入试管中,观察到现象如下:①试管中(填产生沉淀或气体及反应速率等相关现象)两支试管中都产生大量气泡,但盛NaHCO3的试管中反应速率要快得多;
②试管中气球大小(包含试管)体积之比约为(填最简单整数比)Ⅰ:Ⅱ=42:53;
③甲同学用手触摸试管,发现盛NaHCO3粉末的试管变凉,而盛Na2CO3粉末的试管温度有升高.由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应.
甲得出的结论是否正确不正确(填“正确”或“不正确”).
为研究是吸热反应还是放热反应,继续进行了下列实验(每次实验各做3次平行实验,取平均值):(注:每组固体全溶解且完全反应)
| 序号 | 试剂1 | 试剂2 | 混合前 温度 | 混合后最高或 最低温度 |
| A | 50mL水 | 2.5g NaHCO3固体 | 20℃ | 18.5℃ |
| B | 50mL水 | 3.2g Na2CO3固体 | 20℃ | 23.3℃ |
| C | 50mL稀盐酸 | 2.5g NaHCO3固体 | 20℃ | 17.4℃ |
| D | 50mL稀盐酸 | 3.2g Na2CO3固体 | 20℃ | 24.4℃ |
(1)该研究报告的题目是《NaHCO3、Na2CO3和盐酸反应过程中热效应的研究》;
(2)该实验中所用的仪器除试管、药匙(或V形纸槽)、气球、下端带环状玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称为托盘天平和温度计;
(3)通过上述实验可得出两条结论:
a.Na2CO3溶液和盐酸的反应是放热(吸热或放热)反应;
b.NaHCO3溶液和盐酸的反应是吸热(吸热或放热)反应.
4.烃A分子式为C4H10,分子结构中含有一个次甲基( ),则此物质A的二溴代物的种数为( )
),则此物质A的二溴代物的种数为( )
 ),则此物质A的二溴代物的种数为( )
),则此物质A的二溴代物的种数为( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 以上都不对 |
11.有关中和滴定有如下操作:①洗涤;②往滴定管内注入标准溶液;③滴定;④检查滴定管是否漏水;⑤用标准溶液润洗滴定管.其正确的操作顺序是( )
| A. | ⑤①②④③ | B. | ⑤①②④③ | C. | ⑤②①④③ | D. | ④①⑤②③ |
1.将Mg、Cu组成的26.4g混合物投入到适量的稀硝酸中,固体完全溶解,将产生的气体和6.72L(标准状况下)氧气混合通入水中,恰好全部被水吸收.向反应后的溶液中加入足量的4mol/L-1的NaOH溶液,使金属离子完全沉淀.则形成沉淀的质量是( )
| A. | 63.8g | B. | 53.6g | C. | 46.8g | D. | 43.2g |
8.在一密闭容器中充入NO2,在一定条件下进行反应:2NO2?2NO+O2.达到平衡状态的标志是( )
| A. | NO2的消耗速率与NO的生成速率相等 | |
| B. | 容器内压强不随时间变化而变化 | |
| C. | NO2和O2的消耗速率之比为1:1 | |
| D. | 单位时间内生成2n mol NO.同时生成n mol O2 |
5.将醋酸钠饱和溶液加热( )
| A. | 碱性增强 | B. | 碱性不变 | C. | pH不变 | D. | 碱性变弱 |