题目内容
10.a、b两试管中分别盛装足量等体积、等浓度的盐酸溶液,向a、b两试管中加少量等质量的铁粉,同时向a中加入少量CuSO4固体粉末,让a、b两试管同时开始反应,则产生H2的量随时间变化的图象如图所示,其中正确的是( )| A. | 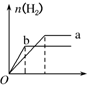 | B. |  | C. | 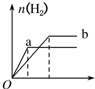 | D. | 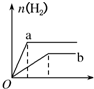 |
分析 a试管中,Fe和CuSO4反应生成硫酸亚铁和Cu,Fe、Cu和盐酸构成原电池,增大反应速率,该反应消耗了Fe,因此生成的氢气体积减小,据此分析解答.
解答 解:a试管中,Fe和CuSO4反应生成硫酸亚铁和Cu,Fe、Cu和盐酸构成原电池,增大反应速率,该反应消耗了Fe,因此生成的氢气体积减小,其图象为 ,
,
故选C.
点评 本题考查化学反应速率影响因素、化学反应计算等知识点,题目难度中等,明确原电池能增大反应速率是解本题关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.将Mg、Cu组成的26.4g混合物投入到适量的稀硝酸中,固体完全溶解,将产生的气体和6.72L(标准状况下)氧气混合通入水中,恰好全部被水吸收.向反应后的溶液中加入足量的4mol/L-1的NaOH溶液,使金属离子完全沉淀.则形成沉淀的质量是( )
| A. | 63.8g | B. | 53.6g | C. | 46.8g | D. | 43.2g |
18.几种短周期元素的原子半径及主要化合价如表:
下列叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A. | R的氧化物对应的水化物可能具有两性 | |
| B. | L、M的单质与稀硫酸反应速率:M>L | |
| C. | T、Q的氢化物常态下均为无色气体 | |
| D. | L、Q形成的简单离子核外电子数相等 |
5.将醋酸钠饱和溶液加热( )
| A. | 碱性增强 | B. | 碱性不变 | C. | pH不变 | D. | 碱性变弱 |
15.下列各原子或离子的电子排布式错误的是( )
| A. | Na+:1s22s22p6 | B. | F:1s22s22p5 | ||
| C. | Cl-:1s22s22p63s23p5 | D. | Mn:1s22s22p63s23p63d54s2 |
2.下列各组气体中,都能用浓硫酸干燥的是( )
| A. | CO、H2、SO2 | B. | SO2、H2S、O2 | C. | HCl、CO2、H2S | D. | H2、SO2 、NH3 |
19.工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气.对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用.
Ⅰ.脱硝:催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的化学方程式为4H2+2NO2$\frac{\underline{\;催化剂\;}}{\;}$N2+4H2O.
Ⅱ.脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在恒温恒容的条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0
(1)下列叙述能说明此反应达到平衡状态的是bce.
a.单位时间内生成n mol CH3OH的同时生成n mol H2O
b.CO2和H2的物质的量分数保持不变
c.CO2和H2的浓度保持不变
d.混合气体的密度保持不变
e.生成1mol CO2生成的同时有3mol H-H键断裂
(2)该反应过程中部分数据见下表:
①20min时,反应是否达到平衡状态?是(填“是”或“否”).
简述理由:20min时,n(CH3OH)为1mol,与30min时相同.
②前10min内的平均反应速率v(CH3OH)=0.025mol•L-1•min-1;
平衡时c(H2)=1.5mol/L;平衡时CO2的转化率为50%.
③在其它条件不变下,若20min时向该密闭容器中通入1mol H2,此时该反应速率将增大(填“增大”或“减小”).
Ⅰ.脱硝:催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的化学方程式为4H2+2NO2$\frac{\underline{\;催化剂\;}}{\;}$N2+4H2O.
Ⅱ.脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在恒温恒容的条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0
(1)下列叙述能说明此反应达到平衡状态的是bce.
a.单位时间内生成n mol CH3OH的同时生成n mol H2O
b.CO2和H2的物质的量分数保持不变
c.CO2和H2的浓度保持不变
d.混合气体的密度保持不变
e.生成1mol CO2生成的同时有3mol H-H键断裂
(2)该反应过程中部分数据见下表:
| 反应时间 | CO2 (mol) | H2 (mol) | CH3OH (mol) | H2O (mol) |
| 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | |||
| 20min | 1 | |||
| 30min | 1 |
简述理由:20min时,n(CH3OH)为1mol,与30min时相同.
②前10min内的平均反应速率v(CH3OH)=0.025mol•L-1•min-1;
平衡时c(H2)=1.5mol/L;平衡时CO2的转化率为50%.
③在其它条件不变下,若20min时向该密闭容器中通入1mol H2,此时该反应速率将增大(填“增大”或“减小”).