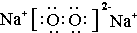题目内容
5.纯碱被视作“碱”用于油污清洗,溶液碱性较强.下列有关分析不正确的是( )| A. | 纯碱主要成分为Na2CO3 | B. | 热的纯碱溶液去污效果更好 | ||
| C. | 纯碱有利于油污水解 | D. | 纯碱常用于治疗胃酸过多 |
分析 A.纯碱为碳酸钠的俗称;
B.碳酸钠溶液中碳酸根离子水解溶液显碱性,水解过程为吸热反应,升温促进水解正向进行;
C.油污是高级脂肪酸甘油酯,碱性溶液中水解生成易溶于水的物质,便于洗涤;
D.纯碱碱性太强,应用碳酸氢钠;
解答 解:A.纯碱是碳酸钠的俗称主要成分为Na2CO3,故A正确;
B.碳酸钠溶液中碳酸根离子水解溶液显碱性,CO32-+H2O?HCO3-+OH-,水解过程为吸热反应,升温促进水解正向进行,溶液碱性增强热的纯碱溶液去污效果更好,故B正确;
C.油污是高级脂肪酸甘油酯,碱性溶液中水解生成易溶于水的物质,便于洗涤,纯碱有利于油污水解,故C正确;
D.纯碱碱性较强,腐蚀性强,若遇到胃溃疡会造成胃穿孔,故D错误;
故选D.
点评 本题考查了盐类水解原理的分析,主要是物质性质的应用,掌握基础是解题关键,题目较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.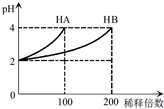 常温下,取pH=2的 HA溶液与HB溶液各1mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示.下列叙述正确的是( )
常温下,取pH=2的 HA溶液与HB溶液各1mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示.下列叙述正确的是( )
 常温下,取pH=2的 HA溶液与HB溶液各1mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示.下列叙述正确的是( )
常温下,取pH=2的 HA溶液与HB溶液各1mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示.下列叙述正确的是( )| A. | HA的电离方程式为HA?H++A- | |
| B. | 稀释前,c(HB)>c(HA)=0.01 mol•L-1 | |
| C. | 0.1mol/L NaB溶液中:c(H+)=c(OH-)+C(HB) | |
| D. | NaA、NaB的混合溶液中:2c(Na+)=c(A-)+c(B-)+c(HB) |
16.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 常温下,22g CO2含碳氧双键数目为2 NA | |
| B. | 12.0g NaHSO4固体中含阳离子数目为0.1 NA | |
| C. | 标准状况下,22.4 L Br2中所含分子数为NA | |
| D. | 7.8 g Na202与足量的水反应转移电子数为0.2 NA |
13.下列实验可达到实验目的是( )
| A. | 用相互滴加的方法鉴别Ca(OH)2和NaHCO3溶液 | |
| B. | 向CH3CH2Br中滴入AgNO3溶液以检验溴元素 | |
| C. | 用溴的四氯化碳溶液吸收SO2气体 | |
| D. | 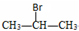 与NaOH的醇溶液共热制备CH3-CH=CH2 与NaOH的醇溶液共热制备CH3-CH=CH2 |
10.下列对如图两烧杯溶液分析一定正确的是( )


| A. | 甲、乙两烧杯中水电离出OH-浓度:甲<乙 | |
| B. | 分别稀释相同倍数,溶液pH变化:甲=乙 | |
| C. | 相同条件,AgCl(s)在甲中溶解度大于在乙中 | |
| D. | 向乙烧杯加入l0.0mL 0.1mol/L NaOH溶液后一定存在:c(H+)=c(CH3COO-)+c(OH-) |
17.短周期主族元素X、Y、Z、W在元素周期表中的相对位置如下图所示.已知X的最低负价与Y的最高正价代数和为零,下列说法正确的是( )
| X | ||||
| Y | Z | W |
| A. | X分别与Y、Z形成的化合物中化学键类型相同 | |
| B. | Z的最高价氧化物的对应水化物酸性比W的强 | |
| C. | X的简单气态氢化物的稳定性比W的弱 | |
| D. | Y是第三周期第ⅡA族元素 |
15.断肠草是葫蔓藤科植物葫蔓藤,其中的毒素很多.以下是分离出来的四种毒素的结构简式:
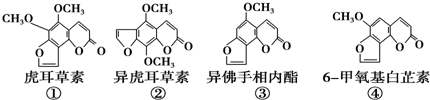
下列推断正确的是( )

下列推断正确的是( )
| A. | ②、③互为同系物 | |
| B. | ①、③各1mol与足量氢氧化钠溶液反应时均消耗3molNaOH | |
| C. | 等物质的量的②、④分别在足量氧气中完全燃烧,前者消耗氧气比后者少 | |
| D. | ③、④互为同分异构体,它们各1mol均能与5molH2加成 |