题目内容
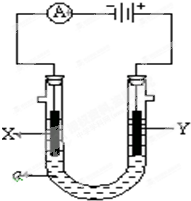 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为
②Y电极上的电极反应式为
③该反应的总反应方程式是:
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是
②Y电极的材料是
(3)若a为CuSO4溶液,则电解时的化学反应方程式为
(4)若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,当阳极产生的气体672mL(标准状况下)时,溶液的C(H+)=
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)电解饱和氯化钠溶液时,由电源可知,X为阴极,Y为阳极,阳极上是氯离子离子失电子,阴极上是氢离子得电子;
(2)根据电解精炼铜的工作原理知识来回答;
(3)若a为CuSO4溶液,则X电极上铜离子放电,当铜离子放电完全后,氢离子再放电;Y电极上氢氧根离子放电;通过一段时间后,向所得溶液中加入0.2molCu(OH)2粉末能使溶液恢复原状,相当于加入0.2molCuO、0.2molH2O,根据氧气和转移电子之间的关系式计算;
(4)若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,阳极上先氯离子放电后氢氧根离子放电,假设阳极上氯离子完全放电,则生成n(Cl2)=
n(NaCl)=0.02mol,当阳极产生的气体672mL(标准状况下)时,生成气体的物质的量=
=0.03mol>0.02mol,在阳极上还有氧气生成,生成氧气的物质的量为0.01mol,阳极上转移电子的物质的量=2n(Cl2)+4n(O2)=0.04mol+0.04mol=0.08mol,阴极上铜离子完全放电时转移电子的物质的量=2×0.04mol=0.08mol,所以阴极上氢离子不放电,根据生成氧气的量计算c(H+).
(2)根据电解精炼铜的工作原理知识来回答;
(3)若a为CuSO4溶液,则X电极上铜离子放电,当铜离子放电完全后,氢离子再放电;Y电极上氢氧根离子放电;通过一段时间后,向所得溶液中加入0.2molCu(OH)2粉末能使溶液恢复原状,相当于加入0.2molCuO、0.2molH2O,根据氧气和转移电子之间的关系式计算;
(4)若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,阳极上先氯离子放电后氢氧根离子放电,假设阳极上氯离子完全放电,则生成n(Cl2)=
| 1 |
| 2 |
| 0.672L |
| 22.4L/mol |
解答:
解:(1)①和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e-=H2↑,
故答案为:2H++2e-=H2↑;
②和电源的正极相连的电极Y极是阳极,该电极上氯离子发生失电子的氧化反应,即2Cl--2e-=Cl2↑,
故答案为:2Cl--2e-=Cl2↑;
③阳极上是氯离子离子失电子,阴极上是氢离子得电子,电解总反应离子方程式为:2Cl-+2H2O═2H2+Cl2↑+2OH-,故答案为:2Cl-+2H2O═2H2+Cl2↑+2OH-;
(2)①电解方法精炼粗铜,X为阴极,电解池的阴极材料是纯铜,电极反应为Cu2++2e-=Cu,故答案为:纯铜;Cu2++2e-=Cu;
②电解方法精炼粗铜,Y为阳极,电解池的阳极材料是粗铜,电极反应为:Cu-2e-=Cu2+,故答案为:粗铜;Cu-2e-=Cu2+;
(3)若a为CuSO4溶液,则X电极上铜离子放电,当铜离子放电完全后,氢离子再放电,Y电极上氢氧根离子放电,所以电池反应式有2CuSO4+2H2O
2Cu+O2↑+2H2SO4、2H2O
O2↑+2H2↑;通过一段时间后,向所得溶液中加入0.2molCu(OH)2粉末能使溶液恢复原状,相当于加入0.2molCuO、0.2molH2O,所以阴极上析出氢气、Cu,根据原子守恒得n(H2)=n(H2O)=0.2mol,n(CuO)=n(Cu)=0.2mol,
设生成0.2molCu转移电子的物质的量为x、生成0.2mol氢气转移电子的物质的量为y,
2CuSO4+2H2O
2Cu+O2↑+2H2SO4转移电子
2mol 4mol
0.2mol x
2mol:4mol=0.2mol:x
x=
=0.4mol
2H2O
O2↑+2H2↑ 转移电子
2mol 4mol
0.2mol y
2mol:4mol=0.2mol:y
y=
=0.4mol,
所以转移电子的物质的量=xmol+ymol=0.4mol+0.4mol=0.8mol;
故答案为:2CuSO4+2H2O
2Cu+O2↑+2H2SO4、2H2O
O2↑+2H2↑;0.8mol;
(4)若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,阳极上先氯离子放电后氢氧根离子放电,假设阳极上氯离子完全放电,
则生成n(Cl2)=
n(NaCl)=0.02mol,当阳极产生的气体672mL(标准状况下)时,生成气体的物质的量=
=0.03mol>0.02mol,
在阳极上还有氧气生成,生成氧气的物质的量为0.01mol,阳极上转移电子的物质的量=2n(Cl2)+4n(O2)=0.04mol+0.04mol=0.08mol,
阴极上铜离子完全放电时转移电子的物质的量=2×0.04mol=0.08mol,
所以阴极上氢离子不放电,当阳极上生成氧气时,同时阳极附近有氢离子生成,电池反应式为2Cu2++2H2O
2Cu+O2↑+4H+,
根据氧气和氢离子的关系式得n(H+)=4n(O2)=0.04mol,
则C(H+)=
=0.1mol/L,
故答案为:0.1mol/L.
故答案为:2H++2e-=H2↑;
②和电源的正极相连的电极Y极是阳极,该电极上氯离子发生失电子的氧化反应,即2Cl--2e-=Cl2↑,
故答案为:2Cl--2e-=Cl2↑;
③阳极上是氯离子离子失电子,阴极上是氢离子得电子,电解总反应离子方程式为:2Cl-+2H2O═2H2+Cl2↑+2OH-,故答案为:2Cl-+2H2O═2H2+Cl2↑+2OH-;
(2)①电解方法精炼粗铜,X为阴极,电解池的阴极材料是纯铜,电极反应为Cu2++2e-=Cu,故答案为:纯铜;Cu2++2e-=Cu;
②电解方法精炼粗铜,Y为阳极,电解池的阳极材料是粗铜,电极反应为:Cu-2e-=Cu2+,故答案为:粗铜;Cu-2e-=Cu2+;
(3)若a为CuSO4溶液,则X电极上铜离子放电,当铜离子放电完全后,氢离子再放电,Y电极上氢氧根离子放电,所以电池反应式有2CuSO4+2H2O
| ||
| ||
设生成0.2molCu转移电子的物质的量为x、生成0.2mol氢气转移电子的物质的量为y,
2CuSO4+2H2O
| ||
2mol 4mol
0.2mol x
2mol:4mol=0.2mol:x
x=
| 4mol×0.2mol |
| 2mol |
2H2O
| ||
2mol 4mol
0.2mol y
2mol:4mol=0.2mol:y
y=
| 4mol×0.2mol |
| 2mol |
所以转移电子的物质的量=xmol+ymol=0.4mol+0.4mol=0.8mol;
故答案为:2CuSO4+2H2O
| ||
| ||
(4)若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,阳极上先氯离子放电后氢氧根离子放电,假设阳极上氯离子完全放电,
则生成n(Cl2)=
| 1 |
| 2 |
| 0.672L |
| 22.4L/mol |
在阳极上还有氧气生成,生成氧气的物质的量为0.01mol,阳极上转移电子的物质的量=2n(Cl2)+4n(O2)=0.04mol+0.04mol=0.08mol,
阴极上铜离子完全放电时转移电子的物质的量=2×0.04mol=0.08mol,
所以阴极上氢离子不放电,当阳极上生成氧气时,同时阳极附近有氢离子生成,电池反应式为2Cu2++2H2O
| ||
根据氧气和氢离子的关系式得n(H+)=4n(O2)=0.04mol,
则C(H+)=
| 0.04mol |
| 0.4L |
故答案为:0.1mol/L.
点评:本题考查学生电解池的工作原理知识,明确图中电源的正负极确定电解池的阴阳极是解答的关键,并熟悉电极反应及离子的放电顺序来解答,题目难度中等.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案
相关题目
对于反应mA+nB═pC,下列说法正确的是( )
| A、某温度时,化学反应速率无论用A、B、C何种物质表示,其数值是相同的 |
| B、其他条件不变,增大压强,反应速率加快 |
| C、若增加或减小B的物质的量,则反应速率一定会发生明显的变化 |
| D、其他条件不变,升高温度,反应速率加快 |
下列说法正确的是(NA为阿伏加德罗常数)( )
| A、标准状况下,1L苯完全燃烧所生成的气态产物的分子数为6/22.4NA |
| B、1 mol甲基(-CH3)所含的电子总数为9NA |
| C、1 mol聚乙烯含有的原子数目为6NA |
| D、12 g金刚石中含有C-C键的个数为NA |


 铜和镍是第四周期重要的过渡元素,它们的单质及化合物具有广泛用途,请回答以下问题:
铜和镍是第四周期重要的过渡元素,它们的单质及化合物具有广泛用途,请回答以下问题: ④HCHO,其中碳原子采取sp2杂化的分子有
④HCHO,其中碳原子采取sp2杂化的分子有 如图是用KMnO4与浓盐酸反应制取适量氯气的简易装置. (提示:在酸性条件下MnO4-被还原为Mn2+)
如图是用KMnO4与浓盐酸反应制取适量氯气的简易装置. (提示:在酸性条件下MnO4-被还原为Mn2+)